
Undersökning av avvikande antal kromosomer i embryot vid assisterad befruktning
En systematisk översikt och utvärdering av effekter, komplikationer, hälsoekonomiska och etiska aspekter av preimplantatorisk genetisk testning för aneuploidi (PGT-A) vid in vitro fertilisering (IVF)
Sammanfattning
Huvudbudskap
Forskning visar att undersökning av antalet kromosomer i embryot (PGT‑A) inte förefaller leda till fler levande födda barn efter assisterad befruktning med in vitro fertilisering (IVF).
Slutsatser
Efter att ha granskat den vetenskapliga litteraturen har SBU dragit följande slutsatser:
- Andelen förlossningar med levande barn förefaller vara jämförbar efter IVF med eller utan preimplantatorisk genetisk testning för aneuploidi (PGT‑A). Detta gäller även för kvinnor 35 år och äldre, men resultaten är mer osäkra.
- Tillägg av PGT‑A vid IVF nästan fördubblar kostnaden för en IVF-behandling1 utan att andelen levande födda barn ökar.
- Det går inte att bedöma om andelen missfall påverkas av tillägg av PGT‑A vid IVF.
- Det går inte att bedöma om tillägg av PGT‑A vid IVF ändrar den totala behandlingstiden till ett levande barn föds eftersom det finns för få studier.
- Det finns inget som tyder på några skillnader i komplikationer för barnet eller den gravida kvinnan då IVF med eller utan biopsi av embryot jämförs.
1. En IVF-behandling avser ett ägguttag och den första embryoåterföringen.
Hur kan de viktigaste resultaten förstås?
Undersökning av antalet kromosomer i embryot (PGT‑A) för att välja vilka embryon som återförs till kvinnans livmoder vid IVF syftar till att öka sannolikheten för att kvinnan ska bli gravid och att ett levande barn ska födas. Syftet med PGT-A är däremot inte att minska antalet barn som föds med kromosomavvikelser eller minska behovet av fosterdiagnostik. PGT-A är inte tillåtet i Sverige men används i flera andra länder. Resultaten i denna rapport visar att PGT-A inte förefaller öka andelen lyckade behandlingar samtidigt som PGT-A medför att kostnaderna för IVF-behandling ökar. För att det ska vara etiskt försvarbart att erbjuda en metod inom hälso- och sjukvården bör det finnas en tydlig nytta som väger upp dess nackdelar.
Fler studier som är välgjorda behövs för att bli mer säkra på resultatet. Forskningen bör inriktas på särskilda patientgrupper för att undersöka om det finns någon grupp av patienter som har nytta av PGT-A.
Vad handlar rapporten om?
Syftet med rapporten var att undersöka om PGT-A leder till fler förlossningar med levande födda barn jämfört med IVF-behandling utan PGT-A, samt om biopsin av embryot kan ge upphov till komplikationer för barnet eller den gravida kvinnan. Rapporten analyserar även hälsoekonomiska och etiska aspekter. Projektet har genomförts inom ramen för ett övergripande uppdrag från regeringen med att ta fram kunskapsunderlag inom området kvinnohälsa.
För att analysera antalet kromosomer i embryot tas vanligen ett antal celler från embryot ut genom en så kallad biopsi. Vid PGT-A analyseras embryots kromosomuppsättning och de embryon som har ett normalt antal kromosomer återförs till kvinnans livmoder vid IVF-behandlingen. De embryon som har ett normalt antal kromosomer kan sannolikt ha en större chans att leda till ett levande fött barn än de embryon som valts bort. Men PGT-A gör också att färre och ibland inga embryon kan återföras eftersom endast embryon utan avvikande antal kromosomer återförs. Det går inte att utesluta att vissa av de embryon som valts bort skulle ha kunnat leda till ett levande fött barn. Det är vanligare att embryon från äldre kvinnor har ett avvikande antal kromosomer och därför har det antagits att dessa kvinnor skulle kunna ha en större nytta av PGT-A.
Vilka underlag baseras resultaten på?
Den senaste sökningen i den vetenskapliga litteraturen gjordes i november år 2024. Resultaten för effekt av PGT-A baseras på sju randomiserade studier med 3 442 deltagare (Avsnitt 5.1). Enbart randomiserade studier som använder de genetiska tekniker som används idag och där samtliga kromosomer analyseras har inkluderats. Komplikationer av IVF med respektive utan biopsi har redovisats i 57 jämförande studier. De hälsoekonomiska resultaten baseras på effektresultaten i rapporten samt svenska registerdata och kostnader.
1. Inledning
1.1 Uppdrag
SBU har fått ett regeringsuppdrag om att ta fram kunskapsunderlag inom området kvinnohälsa (SBU:s regleringsbrev för 2023, dnr S2022/04810). Inom ramen för regeringsuppdraget har bland annat andra myndigheter och representanter för professionen tillfrågats om områden där det finns ett behov av kunskapssammanställningar. Detta projekt är en följd av ett identifierat behov som framfördes av representanter för Svensk förening för Obstetrik och Gynekologi (SFOG).
1.2 Syfte
Syftet med projektet är att utvärdera om undersökning av avvikelser i embryots kromosomantal, med återföring av endast embryon som har ett normalt antal kromosomer, leder till att andelen förlossningar med levande barn ökar vid assisterad befruktning. Undersökning av avvikelser i embryots kromosomantal kallas för preimplantatorisk genetisk testning för aneuploidi (PGT-A) och det är ett test som kan göras i samband med in vitro-fertilisering (IVF) innan embryon förs in i kvinnans2 livmoder. I projektet utvärderas också vilka eventuella komplikationer IVF med PGT kan leda till samt hälsoekonomiska och etiska aspekter av IVF med PGT-A.
IVF med PGT-A är idag inte tillåtet i Sverige, men det används i ett flertal andra länder, både i och utanför Europa. I Sverige finns bland delar av professionen inom reproduktionsmedicin en önskan om att få använda IVF med PGT-A för vissa patientgrupper. Denna utvärdering skulle kunna vara ett bidrag till eventuella framtida överväganden om behovet av att se över regleringen av IVF med PGT-A i Sverige.
2. I rapporten använder vi benämningen kvinna. Med denna benämning inkluderar vi även de som inte definierar sig som kvinnor men som kan tänkas genomgå en IVF-behandling.
1.3 Målgrupper
Målgrupper för rapporten är Regeringskansliet och berörda aktörer inom hälso- och sjukvården så som Socialstyrelsen och Statens medicinsk-etiska råd. Rapporten riktas också till professionen och relevanta patientföreningar så som Riksförbundet ofrivillig barnlöshet, intresseföreningen RFSU samt allmänheten.
2. Bakgrund
2.1 Vad innebär IVF och genetisk testning av embryon med PGT-A?
2.1.1 Assisterad befruktning med IVF
Svårigheter att få barn drabbar cirka 15 procent av befolkningen i fertil ålder [1]. För olikkönade par beror barnlöshet till ungefär lika stora delar på tillstånd hos kvinnan, hos mannen eller hos båda i paret. Vanliga orsaker hos kvinnan är skador på äggledarna, ägglossningsstörning eller endometrios och hos mannen nedsatt antal eller dålig rörlighet hos spermierna. I många fall hittar man ingen orsak. Om det är svårt att uppnå graviditet med egna könsceller kan donation av ägg och/eller spermier bli aktuellt. Spermiedonation används alltid för samkönade kvinnliga par och ensamstående kvinnor.
Assisterad befruktning (assisted reproductive technology, ART) är ett samlingsnamn för alla metoder där ägg och spermier hanteras utanför kroppen och sedan återförs för att uppnå graviditet. Olika typer av IVF (in vitro-fertilisering eller ”provrörsbefruktning”) är idag den vanligaste behandlingen för barnlöshet. I Sverige leder cirka 30 procent av IVF-behandlingscyklerna till ett levande fött barn och totalt sett beräknas cirka två tredjedelar av de som söker vård för svårigheter att få barn kunna få ett levande fött barn efter assisterad befruktning [2]. Det första barnet som tillkom med hjälp av IVF föddes i England år 1978 [3] och idag har det i världen fötts mer än 10 miljoner barn med hjälp av IVF [4]. I Sverige utgör barnen som tillkommit med hjälp av IVF idag cirka 5,5 procent av alla nyfödda barn [2].
Vid IVF stimuleras äggstockarna hormonellt till att producera flera mogna ägg samtidigt [5] (Figur 2.1). Äggblåsorna punkteras och äggen sugs ut med hjälp av en tunn nål via slidan. Äggen befruktas med spermier. De befruktade äggen odlas i inkubatorer där embryoutvecklingen följs. Återförande av embryot till livmodern görs två, tre eller fem dygn efter ägguttaget. Kvinnan ges hormonellt stöd vid återförandet, och man avvaktar därefter graviditetstest.
IVF-behandling och dess resultat relateras ofta till en behandlingscykel. En färsk behandlingscykel innebär en behandling där man ger hormoner till kvinnan i avsikt att stimulera flera äggblåsor till tillväxt, hämtar ut ägg från äggstockarna, befruktar ägg, odlar och återför ett eller flera färska embryon till kvinnan. Om flera befruktade embryon utvecklas, som bedöms vara av god kvalitet3, kan dessa frysas, för att återföras vid senare tillfälle. Vid en fryst/tinad behandlingscykel tinas nedfrysta embryon som återförs till kvinnan i hennes egen menscykel alternativt i en hormonstimulerad cykel. Ett ägguttag kan alltså resultera i flera återföranden av embryon, både av färska och frysta embryon.
3. Innebär att embryot enligt internationell standard bedöms ha en hög potential att implantera i livmodern och ge upphov till en graviditet/födsel.
2.1.2 Genetisk testning av embryon
Preimplantatorisk genetisk testning (PGT) är ett samlingsnamn för olika typer av genetisk analys av embryon (Faktaruta 2.1), och utförs enbart i samband med IVF. PGT ska inte förväxlas med genetisk testning vid fosterdiagnostik som erbjuds under graviditeten vid upptäckt av fostermissbildning, vid en ökad sannolikhet för att fostret har en kromosomavvikelse eller när de blivande föräldrarna är bärare av en ärftlig sjukdom. Genetisk testning vid fosterdiagnostik görs på prov från den gravida kvinnan, antingen från moderkakan, fostervattnet eller via ett blodprov. PGT däremot innebär att genetisk testning utförs på några av embryots celler innan embryot återförs till livmodern vid IVF [6]. Vid PGT görs ett hål i embryots “skal” och celler sugs ut (en så kallad biopsi) (Figur 2.4). Cellerna undersöks sedan genetiskt. Därefter återförs endast embryon som inte har någon kromosomavvikelse, eller anlaget för den ärftliga sjukdomen, till livmodern. PGT introducerades i Storbritannien i början av 1990-talet [7] och är en tekniskt komplicerad och resurskrävande verksamhet. Idag finns även varianter av PGT under utveckling där prov istället tas från vätskan som embryot odlas i, så kallad icke-invasiv genetisk analys [8].
Vid PGT-A, som tidigare kallades PGS (preimplantatorisk genetisk screening), används PGT för att öka sannolikheten för graviditet och förlossning vid IVF, utan att det finns någon känd ökad risk för ärftlig sjukdom hos paret. Det är vanligt förekommande att mänskliga embryon innehåller ett avvikande antal kromosomer. Denna typ av kromosomavvikelse kallas aneuploidi. En cell som har det normala antalet kromosomer (46 stycken) sägs vara euploid. Ett avvikande antal kromosomer hos embryot leder vanligen inte till graviditet och vid graviditet är det en vanlig orsak till tidiga missfall. Detta har lett till antagandet att om man undviker embryon med aneuploidi och återför endast embryon med normalt antal kromosomer så skulle sannolikheten att få barn vid IVF-behandling öka. Det skulle också kunna förkorta den totala behandlingstiden till en graviditet och förlossning. Dock leder åtgärden till att de som gör IVF med PGT-A kan få färre embryon som bedöms kunna återföras (och ibland inga embryon) jämfört med IVF utan PGT-A. Det är också möjligt att embryon som väljs bort vid PGT-A kunde ha lett till ett levande fött barn om det återförts [9] [10]. Att dessa embryon valts bort kan bero på mosacism hos embryot (Faktaruta 2.2), svårtolkat analysresultat eller feldiagnostik. IVF med PGT-A har internationellt främst använts under vissa förutsättningar, till exempel hos kvinnor med något högre ålder, kvinnor som genomgått upprepade misslyckade IVF-behandlingar samt vid upprepade spontana missfall. I vissa länder används dock PGT-A även i ökad utsträckning för andra patientgrupper som till exempel yngre kvinnor.
När ena eller båda de blivande föräldrarna bär på anlag för en ärftlig sjukdom kan andra varianter av PGT vara ett alternativ till fosterdiagnostik med genetisk testning. Vid PGT-M (preimplantatorisk genetisk testning för monogena sjukdomar) används metoden för embryodiagnostik av en ärftlig sjukdom som orsakas av mutation i en gen (monogent nedärvd sjukdom) och vid PGT-SR (preimplantatorisk genetisk testning för kromosomala strukturella förändringar) av en ärftlig kromosomavvikelse, så kallat strukturellt rearrangemang. PGT-M och PGT-SR kallades tidigare preimplantatorisk genetisk diagnostik (PGD). Det finns många ovanliga ärftliga sjukdomar som kan vara orsak till att PGT används, men några exempel är Duchennes muskeldystrofi, Spinal muskelatrofi och Huntingtons sjukdom. Fördelen med PGT-M och PGT-SR jämfört med fosterdiagnostik med genetisk testning är framför allt att ett par med förhöjd risk att få barn med en allvarlig genetisk sjukdom kan påbörja en graviditet i vetskap om att fostret inte ärvt sjukdomen och därmed undviks abort.
2.1.3 Utvärdering av resultatet vid IVF-behandling
Det viktigaste måttet vid all typ av IVF-behandling är andelen förlossningar med levande barn [11]. Man mäter dock ofta även graviditet per behandling samt missfallsfrekvensen, som vanligen räknas som missfall per klinisk graviditet (graviditet som säkerställts med ultraljud). Andelen förlossningar med levande barn kan redovisas för de kvinnor som startat en behandlingscykel, för de som gjort ett ägguttag eller för de med en genomförd embryoåterföring (Figur 2.1). Andelen förlossningar med levande barn kan också redovisas för alla embryoåterföringar från ett ägguttag, såväl den färska återföringen som samtliga återföringar av frysta embryon (om sådana finns). Det totala resultatet från ett ägguttag benämns som kumulativ förlossningsfrekvens, vilket anger andel kvinnor som uppnår minst en förlossning med levande barn efter ett ägguttag [12]. Kumulativ förlossningsfrekvens påverkas mindre av antalet embryon per återföring och odlingstiden [13]. Problemet är dock att det är svårt att utvärdera detta i studier då det tar lång tid om man ska vänta tills samtliga embryon är återförda.
I randomiserade studier om infertilitet ska resultat rapporteras per randomiserad kvinna i enlighet med en framtagen uppsättning prioriterade utfall inom området (core outcome set) [11]. Detta är detsamma som en intention-to-treat (ITT) analys där alla randomiserade deltagare som tilldelats en viss intervention i en randomiserad studie ingår. En ITT-analys är grunden för att på ett korrekt sätt utvärdera en intervention utan att resultatet påverkas av skillnader mellan patientgrupperna som jämförs. I randomiserade studier avseende PGT-A kan randomiseringen ha ägt rum vid olika tidpunkter i IVF-behandlingen, till exempel vid start av en behandlingscykel, efter ett ägguttag eller när embryon finns tillgängliga för återföring (med eller utan biopsi) (Figur 2.1). I analyser per randomiserad kvinna redovisas andelen förlossningar med levande barn oavsett om en embryoåterföring genomförts eller inte. Vid redovisning per randomiserad kvinna ingår antingen alla kvinnor som planerades att få en embryoåterföring, eller kvinnornas samtliga embryoåterföringar från ett ägguttag (kvinnorna kan ha fått en eller flera embryoåterföringar eller ingen embryoåterföring) (Figur 2.2).
Andelen förlossningar med levande barn redovisas ofta enbart för kvinnor med en genomförd embryoåterföring, men detta utfallsmått ger en felaktig bild vid utvärdering av en intervention som PGT-A. Dels för att inte alla kvinnor som randomiserats i studien ingår och patientgrupperna därför kan skilja sig åt. Dels för att detta utfallsmått utesluter alla de kvinnor som inte hade några kromosomalt lämpliga embryon att återföra efter PGT-A (Figur 2.2), eller av andra skäl inte hade några embryon att återföra (Figur 2.1). PGT-A leder till färre embryon att återföra eftersom de aneuploida och även i många fall de mosaiska embryona valts bort, vilket innebär att färre kvinnor kommer genomgå en återföring och det kan påverka den totala graviditets- och förlossningsfrekvensen negativt.
Nedan visas det kliniska händelseförloppet efter ett ägguttag vid IVF-behandling med eller utan PGT-A, samt vad som ingår i de olika utfallsmåtten (Figur 2.2).
Flödet går från vänster till höger och börjar med patientgruppen för vilka valet mellan IVF med eller utan PGT-A kan vara aktuellt. Vid IVF görs en morfologisk undersökning av embryots utseende och celldelning. Embryon som bedöms vara av god kvalitet kan återföras; alternativt kan inget embryo återföras. Vid tillägg av PGT-A görs en genetisk analys, där euploida embryon väljs ut för återföring. Efter en återföring blir en viss andel av kvinnorna gravida, detta kan leda till förlossning med levande barn eller sluta i missfall. Om den första embryoåterföringen inte resulterar i en förlossning med levande barn och det finns frysta embryon kvar kan ytterligare försök göras, tills embryona tar slut. Överst i bilden illustrerar pilar vilka delar i händelseförloppet som ingår då de olika utfallen utvärderas: resultatet för den första planerade embryoåterföringen och resultatet av alla embryoåterföringar från ett ägguttag redovisas för alla kvinnor som randomiserats, medan resultatet av den första genomförda embryoåterföringen bara redovisas för de som har ett embryo som kan återföras.
2.2 Embryots utveckling
I ett normalt befruktat ägg ses två stycken kärnor (så kallad pronuklei), en från spermien och en från ägget (Figur 2.3). Dessa smälter under första dygnet samman till en kärna som då består till hälften av vardera kvinnans respektive mannens kromosomer. Ett befruktat ägg har även två stycken polkroppar, som endast innehåller kromosomer från kvinnan. Polkropparna stöts ut från ägget innan celldelningarna startar, men ligger kvar under äggskalet under de första celldelningarna.
Under utvecklingen från en enda cell dag 0, till en så kallad blastocyst dag 5–6, genomgår embryot 7–8 celldelningar som var och en fördubblar antalet celler (Figur 2.3). Med start ungefär dag 4 (morula) utvecklas vissa celler till ett yttre omgivande cellager, trofektoderm (TF), och vissa celler bildar ett inre lager, den så kallade inre cellmassan (ICM). Det är den inre cellmassan som senare utvecklas till ett foster. Parallellt med detta expanderar embryot (nu kallat en blastocyst) och ett vätskefyllt hålrum bildas.
2.2.1 Bedömning av embryon vid IVF
Vid IVF odlas embryon i inkubatorer på laboratorium under kontrollerade förhållanden och embryoutvecklingen följs i mikroskop för att bedöma vilka embryon som är lämpliga att återföra till kvinnan [14]. Efter att spermierna befruktat äggen odlar man vidare de ägg som bedöms vara normalt befruktade, det vill säga att man kan se en kärna från ägget och en från spermien samt två polkroppar. Celldelning och morfologi (utseendet på embryot) bedöms vid specificerade tidpunkter. För att ett embryo ska fästa i livmodern (implantera) och ha möjlighet att leda till graviditet bör cellerna i embryot dela sig ungefär samtidigt och med en viss hastighet (Figur 2.3). Även embryots morfologi är av stor vikt för möjligheten att implantera i livmodern.
Embryon kan återföras i princip i vilket stadium som helst, fram till och med dag 5 eller 6 efter befruktning. Det kan dock vara olika svårt att bedöma morfologi och välja ut det embryo som har bäst möjligheter beroende på utvecklingsstadium. Vanligtvis väljer man att återföra embryot i 4–8-cells stadiet (dag 2–3) eller att odla det vidare till blastocyststadiet (dag 5–6) (Figur 2.3). Att odla embryot till det senare stadiet ökar sannolikheten för att i första hand kunna återföra ett embryo med bättre chans att implantera i livmodern [15]. Därmed ökar sannolikheten att snabbare uppnå en graviditet. Nackdelen är en viss risk att inget embryo överlever den längre odlingstiden, samtidigt som embryona kanske hade kunnat ge upphov till en graviditet om de återförts tidigare.
2.2.2 Nedfrysning av embryon
Nedfrysning av embryon kan göras av flera olika anledningar. En vanlig anledning är att flera embryon har god kvalitet och att man väljer att återföra ett embryo i taget för att minska risken för graviditeter med flera foster (flerbörd). De embryon som inte återförs fryses. I vissa fall fryses alla embryon av god kvalitet, till exempel för att bevara möjligheten till fertilitet vid sjukdom eller för att minska de risker som kan bli följden av för kraftig stimulering av äggstockarna. Vid PGT-behandling med biopsi i den senare delen av embryoutvecklingen (blastocyststadiet) måste embryona frysas i väntan på att den genetiska analysen ska bli klar.
Ett embryo som fryses i blastocyststadiet har en mycket hög sannolikhet att överleva vid upptining (vanligen >95 %) och lika god möjlighet till implantation som ett färskt embryo [2].
2.3 Hur går PGT till?
2.3.1 Biopsi för PGT
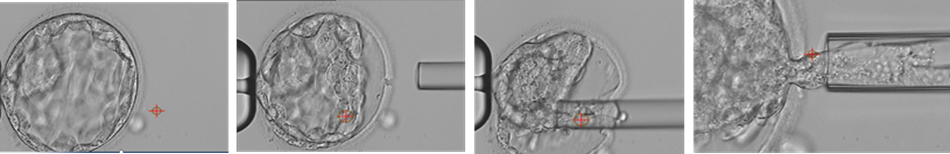
Vid en embryobiopsi skapas ett hål i äggskalet och en eller flera av embryots celler sugs ut med hjälp av en tunn pipett (Figur 2.4). Embryot hålls på plats med hjälp av en så kallad hållpipett. Hålet i äggskalet skapas antingen genom att bespruta en begränsad del av skalets yta med en sur lösning, eller genom att skalet beskjuts med en laserstråle [16].
Biopsi kan göras vid olika stadier i embryoutvecklingen. Från det befruktade ägget kan man suga ut polkropparna, som enbart innehåller kvinnans kromosomer, och analysera det genetiska innehållet i dessa. Polkropparna deltar inte i embryoutvecklingen och kommer ändå stötas bort.
För att kunna analysera kromosomerna från både kvinnan och mannen måste man suga ut celler från själva embryot. Tidigare gjordes detta dag 3 efter befruktning, då embryot består av 6–10 celler (Figur 2.4). För att inte för stor andel av den totala cellmassan skulle tas bort togs endast 1–2 celler ut. Studier har visat att om två celler sögs ut från embryot så resulterade det i färre graviditeter/födslar än om bara en cell togs [17]. Dock var det större risk för feldiagnos alternativt inget analysresultat om bara en cell togs.
Under senare år, parallellt med att förlängd odling av embryon till blastocyststadiet blivit vanligare och mer framgångsrikt, har även embryobiopsin övergått till att göras på blastocyststadiet. Det innebär att fler celler kan tas ut, cirka 5-10 celler av totalt 50-200, vilket ger ett säkrare analysresultat och samtidigt en mindre påverkan på den totala cellmassan. Man tar alltid cellerna från det yttre cellagret (trofektodermcellerna), och undviker den inre cellmassan (ICM) som bildar själva fostret.
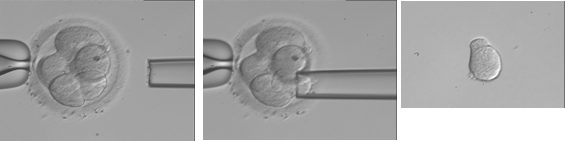
A) Biopsi av en cell från ett 8-cells embryo (dag 3). Ett hål görs i äggskalet. En tunn biopsinål förs in genom öppningen, och en cell sugs ut.
Den/de celler som tagits ut förs över till ett rör med en vätska som löser upp cellernas membran inför analysen av DNA:t. Om biopsin gjorts tidigt i embryoutvecklingen (dag 3) kan embryo(n) med normal kromosom/genuppsättning återföras i den färska behandlingscykeln. Men vanligen fryses biopserade embryon i väntan på analysresultatet, och återföring av embryo(n) med normal kromosom/genuppsättning sker sedan i en senare behandlingscykel.
2.3.2 Genetiska metoder för PGT
Vid PGT sker den genetiska analysen på ett fåtal embryoceller, vilket innebär speciella förutsättningar och vissa begränsningar. Nya genetiska analysmetoder utvecklas kontinuerligt och eftersom PGT har använts i flera decennier så förekommer olika typer av analysmetoder vid PGT i den medicinska litteraturen.
Fluorescent in situ hybridisering (FISH) användes som analysmetod för PGT-A under 1990-talet och framåt [18]. Med denna metod kunde endast ett begränsat antal kromosomer analyseras. FISH ersattes på 2010-talet av mikroarraytekniken (CGH-array, SNP-array) och liknande tekniker som möjliggjorde analys av alla kromosomerna. Mikroarraytekniken har sedan sista åren på 2010-talet successivt ersatts av helgenomsekvensering (NGS, next generation sequencing), där hela arvsmassan undersöks. Med helgenomsekvensering kan man avgöra om det finns för mycket eller för lite kromosommaterial, eller om embryot har ärvt den sjukdom man vill undvika. Då helgenomsekvensering används för PGT-A ser man inte bara antalet kromosomer utan också större förändringar i enskilda kromosomer, som till exempel om delar av någon kromosom saknas.
2.4 Reglering av IVF och PGT
2.4.1 IVF i Sverige
Assisterad befruktning regleras i Lagen om genetisk integritet (Lag om genetisk integritet m.m. SFS 2006:351) [23]. Lagstiftningen har genomgått ett flertal förändringar genom åren.
Här listas några milstolpar avseende utvecklingen av IVF i Sverige:
- 2003: Äggdonation blir tillåtet
- 2005: Behandling av samkönade par blir tillåtet
- 2016: Behandling av ensamstående kvinnor blir tillåtet
- 2019: Kravet avseende genetisk koppling till barnet tas bort och det blir tillåtet med behandlingar med enbart donerade könsceller (både ägg och spermier) liksom behandling med donerade embryon
- 2019: Tillåten frysförvaringstid för embryon ökar från fem till tio år
- 2019: Beslut tas om att inte tillåta surrogatmödraskap inom svensk hälso- och sjukvård.
Vid all utredning och behandling med assisterad befruktning har barnets bästa en central roll, det får inte föreligga någon medicinsk eller psykosocial kontraindikation mot graviditet och infektionsscreening ska göras [24] [25].
IVF-behandling kan göras inom offentlig eller privat vård. Inom offentlig vård ser rekommendationen likadan ut i samtliga regioner [26]. Regionen står för kostnaden för upp till tre IVF-behandlingar (tre ägguttag och samtliga påföljande embryoåterföringar) eller till ett barn föds. Behöver man göra fler än tre behandlingar eller om man önskar syskon får patienterna själva stå för kostnaden. Inom privat vård står patienterna för alla kostnader förutom läkemedel.
Inom offentlig vård är övre åldersgräns för ägguttag för kvinnan 40 år och för partner 56 år [26]. Återförande av fryst/tinat embryo är möjligt upp till 45 respektive 61-årsdagen. Inom privat vård kan något högre ålder accepteras. För offentligt finansierad vård ställs krav på hur lång tid man försökt uppnå graviditet (oftast 1 år) före behandling, helst folkbokföring på samma adress, par får inte ha gemensamt barn och ensamstående får inte ha barn, endera partnern får inte vara steriliserad, och kvinnan får inte ha ett BMI över en viss gräns [26].
2.4.2 PGT
I Sverige är PGT tillåtet för att upptäcka embryon med genetiska avvikelser när föräldrarna bär på anlag för allvarlig sjukdom (PGT-M och PGT-SR) [23]. PGT är ett tillståndsområde inom nationell högspecialiserad vård som är begränsat till två centra i Sverige, Karolinska Universitetssjukhuset i Stockholm respektive Sahlgrenska Universitetssjukhuset i Göteborg [27]. PGT har varit i kliniskt bruk i Sverige sedan mitten på 1990-talet. Det har fötts hundratals barn efter PGT för ärftliga sjukdomar i Sverige och det görs i dagsläget 300–350 behandlingar per år [28]. Eftersom PGT-M och PGT-SR utförs i Sverige finns de embryologiska och genetiska metoder som även används vid PGT-A etablerade inom svensk sjukvård.
PGT-A är dock inte tillåtet i Sverige idag, förutom inom ramen för definierade forskningsprojekt [23] [29]. I det kunskapsläge som rådde vid tiden för arbetet med proposition och nuvarande lag om genetisk integritet med mera [23] ansåg man inte att PGT-A borde få användas rutinmässigt utan att det borde reserveras för forskningsprojekt inriktade på kvinnor med låg sannolikhet till graviditet, där det finns särskild anledning att tro att behandlingen skulle öka chanserna [29]. Man ansåg också att innan man kan göra en fullständig etisk bedömning behövs forskning och resultat som visar vilka möjliga fördelar respektive nackdelar denna teknik kan ha ur medicinskt, etiskt och samhälleligt perspektiv.
PGT-A används i ett flertal andra länder, både i och utanför Europa [30]. I Norden är PGT-A tillåtet i Finland och Island. I Danmark liksom i Sverige är det endast tillåtet inom ramen för definierade forskningsprojekt och i Norge är PGT-A inte tillåtet. I 32 av 44 europeiska länder är PGT-A antingen uttryckligen tillåtet, eller tillåtet på grund av avsaknad av reglering [30]. I en del länder är PGT-A vanligt förekommande och används i vissa fall för upp till hälften av IVF-behandlingarna [31]. Liksom andra former av assisterad befruktning är PGT-A etiskt omdiskuterat internationellt och skillnader i praxis mellan länder beror bland annat på att olika länder gjort olika etiska ställningstaganden. Det pågår även en debatt i länder där PGT-A tillåts som relaterar till att kliniker marknadsfört PGT-A som en bevisat effektiv metod för att förbättra chanserna vid IVF [32]. Patienter som efter PGT-A testet inte haft några embryon att återföra har i flera fall stämt klinikerna för vilseledande marknadsföring kring effekten av PGT-A. I Sverige däremot förekommer det att svenskar som planerar att genomgå fertilitetsbehandling reser utomlands för att få tillgång till metoden [33].
Inte heller PGT-P är tillåtet i Sverige, men det används i vissa andra länder [34]. Orsaken till att PGT-A och PGT-P inte är tillåtet är för att genetisk testning av embryon endast är tillåtet om föräldrarna bär på anlag för en allvarlig sjukdom. Ett undantag är dock PGT-HLA som innebär genetisk testning för att välja att återföra ett embryo med en sådan genetisk uppsättning att barnet skulle kunna bli donator av blodstamceller till ett svårt sjukt syskon. Detta är tillåtet efter tillstånd från Socialstyrelsen (Lag om genetisk integritet m.m.) [23].
2.5 Praxis vid IVF-behandlingar i Sverige
Under de drygt 45 år som IVF-tekniken har använts har den utvecklats mycket, både vad gäller förlossningsresultat och säkerhet för mödrar och barn. Idag kan IVF erbjudas till många fler patientgrupper och behandlingarna har förenklats betydligt.
Nationella kvalitetsregistret för assisterad befruktning (Q-IVF) startade år 2007 [28]. Den senaste årsrapporten avser samtliga behandlingar som startades under år 2022 i Sverige, vid de IVF-kliniker, 6 offentliga och 18 privata, som då bedrev verksamhet [2]. Man kan här följa IVF-resultat avseende framför allt graviditeter och förlossningar, komplikationer, samt vårdens kvalitet från ett patientperspektiv.
Totalt utförs drygt 25 000 IVF-behandlingar i Sverige årligen, inkluderande behandlingar med färska eller frysta embryon [28]. Majoriteten av behandlingarna sker med parets egna könsceller och drygt 20 procent med donerade ägg eller spermier. Det föddes drygt 5 800 barn efter IVF-behandlingar i Sverige år 2022.
Av totala antalet IVF-behandlingar årligen i Sverige görs cirka hälften med vanlig IVF där ägg och spermier läggs i samma odlingsskål och befruktning sker utan ytterligare yttre hjälp, och hälften med ICSI (intracytoplasmatisk spermieinjektion). ICSI är en metod där spermien injiceras in i ägget och används framför allt när spermieantal eller kvalitet är nedsatt. Resultaten i form av förlossningsfrekvens är likvärdiga för standard IVF och ICSI. ICSI används i princip alltid vid PGT för att minimera risken för felaktig diagnostik ifall en extra spermie skulle komma med vid analysen.
Traditionellt sett har det i Sverige, liksom i övriga delar av världen, utförts betydligt större andel IVF-behandlingar med färska embryon än med frysta. Under senare år har teknikutvecklingen inom IVF lett till en ökad andel frysta embryoåterföranden. Antalet behandlingar med frysta embryon överstiger numera antalet färska behandlingar och förlossningsfrekvenserna är likvärdiga. På liknande vis har det skett en förskjutning mot längre odlingstider. För frysta embryon återförs nu i Sverige nästan 100 procent i blastocyststadiet. För färska embryon är motsvarande siffra cirka 35 procent. Anledningen till denna skillnad är att vid färska cykler och fåtal embryon av god kvalitet så anser man i Sverige att återföring på dag 2 eller 3 kan vara mer fördelaktigt eftersom det finns en risk att embryona inte överlever vid längre odlingstid.
Det har tidigare varit vanligt att återföra flera embryon samtidigt vid IVF-behandlingar, vilket har resulterat i en hög andel graviditeter med flera barn (flerbörd). Sverige har varit ett föregångsland i att minska antalet embryon vid återföring till enbart ett embryo [35], vilket dramatiskt minskat flerbördsfrekvensen och riskerna för barnen. Flerbördsfrekvensen efter spontan graviditet är cirka 1 procent. Flerbördsfrekvensen efter IVF-behandling var i Sverige över 30 procent på 1990-talet, men är idag cirka två procent. I många länder är dock flerbördsfrekvensen fortsatt hög efter IVF. Flerbörd har en stark koppling till tillstånd som förknippas med sjuklighet hos barnen, så som låg födelsevikt och för tidig födsel.
3. Metod
Detta avsnitt beskriver frågor, urvalskriterier och metodik för de olika delarna av rapporten. Syftet med en systematisk översikt är att få en kartläggning och bedömning av kunskapsläget utifrån den forskning som är genomförd på området. För mer information om metodiken hänvisar vi till SBU:s metodbok [36].
Projektprocessen följde de internationella riktlinjerna för systematiska översikter, PRISMA [37]. Vår projektplan finns registrerad i PROSPERO [38] och International HTA database (INAHTA) [39].
3.1 Frågor
Våra frågeställningar var:
- Vilken effekt på graviditetsutfall och livskvalitet har preimplantatorisk genetisk testning för aneuploidi (PGT-A), med analys av samtliga kromosomer, vid in vitro-fertilisering (IVF)?
- Vilka komplikationer för barnet och den gravida kvinnan kan IVF-behandling med embryobiopsi vid preimplantatorisk genetisk testning (oavsett form av PGT) ge upphov till?
- Vad är relationen mellan kostnader och effekter av IVF med PGT-A jämfört med IVF utan PGT-A?
- Vilka etiska aspekter av relevans i ett svenskt sammanhang är förknippade med PGT- A vid IVF?
3.2 Metod för översikt av effekter på hälsa
3.2.1 Urvalskriterier
Som grund för arbetet definierade vi översiktens inklusionskriterier, det vill säga våra avgränsningar. Förutom kriterier enligt det vedertagna formatet PICO (Population, Intervention, Control, Outcome) lade vi till begränsningar i studiedesign, publikationstyp och språk. Eftersom avgränsningarna skilde sig en del för fråga ett och två så har vi två olika PICO:n, PICO 1 för effekt och PICO 2 för komplikationer.
3.2.1.1 PICO 1: Effekt på fertilitetsbehandlingen av PGT-A
Population
Kvinnor som genomgår IVF-behandling.
Intervention
IVF-behandling med PGT-A4. För alla utfall utom livskvalitet krävdes att samtliga kromosomer analyserades med den genetiska analysmetoden.
Kontrollgrupp
IVF-behandling utan PGT-A, det vill säga utan analys av embryonas kromosomer.
Studier uteslöts om studieupplägget var att antalet embryon som återfördes vid en embryoåterföring skulle vara olika i interventions- och kontrollgruppen.
Utfallsmått
Primära utfall
Våra primära utfall var andel förlossningar med minst ett levande barn (som vi kommer kalla andel förlossningar med levande barn) per kvinna som randomiserats till någon av jämförelsegrupperna i studierna. Detta är i enlighet med en framtagen uppsättning prioriterade utfall (core outcome set) för forskning om infertilitet [11]. Det är också en så kallad ITT-analys som rekommenderas i första hand när randomiserade studier som avser visa en skillnad analyseras.
Resultatet kan antingen redovisas för den första planerade embryoåterföringen eller kumulativt för alla embryoåterföringar från ett ägguttag för alla kvinnor som randomiserats (Avsnitt 2.1.3 och Figur 2.2). Resultatet för den första planerade embryoåterföringen kan komma från en embryoåterföring (färsk eller fryst) eller ingen embryoåterföring om inget lämpligt embryo fanns. Resultatet för ett ägguttag kan komma från såväl den färska embryoåterföringen som samtliga frysta/tinade återföringar eller ingen embryoåterföring. Detta kallas även kumulativ förlossningsfrekvens [12] och anges som andel kvinnor som uppnådde åtminstone en förlossning med minst ett levande barn efter ett ägguttag, det vill säga förlossningsfrekvensen är 0 eller 1.
Sekundära utfall
Sekundära utfall var andel förlossningar med levande barn för enbart kvinnor med en genomförd embryoåterföring (Avsnitt 2.1.3 och Figur 2.2) samt andel graviditeter, andel missfall av de med en klinisk graviditet (graviditet som säkerställts med ultraljud) och andel ektopiska graviditeter (utanför livmodern). Även den totala behandlingstiden till graviditet eller förlossning samt livskvalitet för kvinnan och partnern inkluderades.
Studiedesign
Endast randomiserade kontrollerade studier (RCT-studier) accepterades för utvärdering av effekten på fertilitetsbehandlingen av PGT-A.
4. Med PGT-A menar vi analys av embryots kromosomer, både efter invasiv biopsi av embryot och efter icke-invasiv testning av cellmediet.
3.2.1.2 PICO 2: Komplikationer av alla former av PGT
Population
Barn som kommit till genom IVF och kvinnor som genomgått IVF.
Intervention
IVF-behandling med biopsi av embryot eller det befruktade ägget för att utföra någon form av preimplantatorisk genetisk testning (PGT), det vill säga PGT-A, PGT-M eller PGT-SR.
Kontrollgrupp
IVF-behandling utan biopsi av embryot.
Utfallsmått
För barn som tillkommit genom IVF inkluderade vi möjliga komplikationer för fostret och spädbarnet (perinatala komplikationer) samt möjliga komplikationer senare i barnets liv. Missfall och kromosomavvikelser inkluderades inte som komplikationsutfall. Missfall, som ingår i PICO 1, ses som ett effektmått vid IVF-behandling med PGT-A, eftersom ett mål med PGT-A är att minska risken för missfall. Det är inte sannolikt att biopsi av embryon skulle leda till kromosomavvikelser utan om detta ses efter PGT-A beror det sannolikt på diagnostiska problem.
För den gravida kvinnan inkluderade vi komplikationer relaterade till moderkakan som biopsin teoretiskt skulle kunna påverka [40]. Dessa är hypertonisjukdomar under graviditeten (graviditetshypertoni (högt blodtryck vid graviditet)), preeklampsi (havandeskapsförgiftning), eklampsi (kramper vid havandeskapsförgiftning), placenta previa (moderkakan täcker öppningen till livmoderhalsen), placentaavlossning (moderkaksavlossning), onormal postpartumblödning och placenta accreta (moderkakan sitter fast i livmodern) och placenta percreta (moderkakan växer genom livmoderväggen).
Studiedesign
Vi accepterade studier med eller utan randomisering som hade en kontrollgrupp för utvärdering av komplikationer vid PGT (RCT-studier eller observationsstudier). De kunde vara prospektiva eller retrospektiva.
3.2.1.3 Övriga avgränsningar för både PICO 1 och 2
Vi inkluderade fulltextartiklar som publicerats i sakkunniggranskade tidskrifter (peer-reviewed journals). Enbart artiklar skrivna på engelska, svenska, norska eller danska inkluderades.
Systematiska översikter som hade publicerats de fyra senaste åren och som följer PRISMA standard eller liknande inkluderades för att tidigt fastställa behovet av en systematisk översikt och senare för att kontrollera att vi inte missat några relevanta originalstudier.
3.2.2 Process för urval av studier
Med utgångspunkt i urvalskriterierna har vi identifierat och valt ut litteratur i fyra steg:
- Litteratursökning i ämnesrelevanta databaser
- Relevansgranskning av artikelsammanfattningar (abstrakts) utifrån urvalskriterierna
- Relevansgranskning av fulltextartiklar utifrån urvalskriterierna
- Granskning och bedömning av risk för bias i de studier som bedömts vara relevanta.
3.2.2.1 Litteratursökning
För översikten om effekter på hälsa gjordes sökningar med en uttömmande ansats, för att identifiera studier om effekter och komplikationer. Inledningsvis söktes också efter systematiska översikter. Utöver det gjordes sökningar efter studieprotokoll. Innan publicering kontrollerades att ingen av de publikationer som inkluderats i rapporten hade dragits tillbaka, exempelvis på grund av oegentligheter eller forskningsfusk.
En informationsspecialist utformade strukturerade och uttömmande sökstrategier, och genomförde litteratursökningarna i samråd med projektets sakkunniga och projektledare. Sökstrategierna redovisas i sin helhet i Appendix 1.
Informationskällor
Strukturerade och uttömmande litteratursökningar gjordes under perioden december år 2023 till februari år 2024, för att sedan uppdateras i november år 2024. Sökningarna för effektstudier och komplikationer utfördes i följande databaser:
- CINAHL (EBSCO)
- Cochrane Library (Wiley)
- EMBASE (Embase.com)
- Medline (Ovid)
- PsycINFO (EBSCO)
- PubMed (NLM)
- Scopus (Elsevier).
Sökningar för systematiska översikter gjordes i följande databaser:
- EMBASE (Embase.com)
- International HTA Database (INAHTA)
- Medline (Ovid)
- Prospero (National Institute for Health and Care Research).
Sökningar för studieprotokoll gjordes i följande databaser:
- Clinicaltrials.gov (NLM)
- International Clinical Trials Registry Platform (ICTRP) (WHO).
Sökningarna kompletterades med litteratur som identifierats via citeringssökningar i Scopus, från referenslistor från publicerade artiklar och genom kontakt med sakkunniga.
Sökstrategi
Sökstrategierna utvecklades genom att delvis återanvända sökstrategier och söktermer från andra systematiska översikter på området, samt genom att analysera nyckelartiklar inom området.
Innan uppdateringssökningen kontrollerades ämnesordslistor efter termer som tillkommit sedan huvudsökningen. Inga nytillkomna relevanta termer identifierades.
Sökstrategierna granskades av en annan informationsspecialist på SBU.
Avgränsningar
Vid sökningarna gjordes avgränsningar till publikationer på språken engelska, svenska, norska och danska.
För sökningen på effektstudier användes validerade sökfilter för studiedesign, där sådana fanns tillgängliga.
3.2.2.2 Bedömning av relevans
Litteratursökningarna resulterade i en lista med artikelsammanfattningar (abstrakts) som rensades på dubbletter, både i EndNote [41] [42] och Covidence [43]. Programmet Covidence användes för att granska artikelsammanfattningar och fulltexter samt bedöma risken för bias i studierna.
Två projektdeltagare gallrade oberoende av varandra bort artikelsammanfattningar som inte uppfyllde våra urvalskrav (Avsnitt 3.2.1). Sammanfattningar som minst en av granskarna bedömde uppfyllde urvalskriterierna granskades i fulltext. Studier som beskrev etiska aspekter av PGT-A samt kvalitativa studier av patienters och behandlares erfarenheter markerades och användes i arbetet med att undersöka etiska aspekter.
Studierna i fulltext lästes av en sakkunnig och en projektledare som oberoende av varandra bedömde deras relevans. Eventuella oenigheter löstes genom diskussion mellan bedömarna. Svårbedömda studier togs upp för diskussion och bedömning i hela projektgruppen. Studier som inte uppfyllde kriterierna sorterades bort och orsaken noterades (Appendix 2). Projektgruppens sakkunniga bedömde inte artiklar som de själva var medförfattare till.
3.2.2.3 Bedömning av risk för bias
De studier som bedömdes vara relevanta granskades för att bedöma risken för att resultaten i studierna blivit snedvridna på grund av systematiska fel, det vill säga risken för bias. Granskningen utfördes först av en sakkunnig och en projektledare oberoende av varandra som därefter diskuterade och jämförde sina bedömningar. Svårbedömda studier togs upp för diskussion och beslut i hela projektgruppen.
Bedömningen av risk för bias utfördes med hjälp av standardiserade mallar som anpassats för projektet (Appendix 3). Vid framtagandet av mallarna utgick vi ifrån Cochranes granskningsmallar för bedömning av randomiserade studier (RoB 2) samt icke-randomiserade interventionsstudier (ROBINS-I).
Vi valde att för både randomiserade och icke-randomiserade studier dela in resultatet av risk för bias bedömningen i kategorierna låg, måttlig, hög eller oacceptabelt hög risk för bias, i enlighet med Cochranes mall för icke-randomiserade studier (Tabell 3.1) [44]. Bedömningarna gjordes för varje enskilt utfall som uppfyllde våra relevanskriterier i de inkluderade studierna. Utfall med låg till hög risk för bias inkluderades i översikten eftersom de bedömdes kunna bidra med information om interventionens effekt eller komplikationer. Utfall som bedömdes ha oacceptabelt hög risk för bias uteslöts med argumentet att de inte bidrar till någon evidensbaserad kunskap om interventionens effekt eller komplikationer.
| Bedömning | Betydelse |
|---|---|
| Låg risk för bias | Välgjord RCT-studie eller studien är jämförbar med en välgjord RCT-studie |
| Måttlig risk för bias | Studien är välgjord men har vissa brister som inte bedöms vara allvarliga |
| Hög risk för bias | Studien har en eller flera betydelsebärande brister* |
| Oacceptabelt hög risk för bias | Studien har alltför många eller stora brister för att bidra med någon användbar evidens och bör inte inkluderas i någon syntes |
| RCT = randomiserad kontrollerad studie. *Studien bedöms trots bristerna kunna bidra till information om interventionens effekt eller komplikationer. |
|
För RCT-studier som utvärderade effekten av IVF med PGT-A hade vi följande generella krav för att utfallen skulle kunna bedömas ha en låg risk för bias; randomiseringen gjordes av oberoende part, ingen åldersskillnad mellan grupperna vid start (medelvärden samt median eller stratifiering för ålder krävdes), studiedeltagare och behandlare kände inte till grupptillhörighet (de var blindade) i de fall randomiseringen gjordes innan embryon för biopsi fanns tillgängliga samt liknande andelar och orsaker till bortfall i grupperna. För samtliga effekt- och komplikationsstudier krävdes att ett studieprotokoll fanns för att utfallen skulle kunna bedömas ha låg risk för bias.
För att minska risken för att andra faktorer än embryobiopsin är orsak till skillnader i komplikationer för de som genomgått respektive inte genomgått PGT ställde vi vissa krav. Störfaktorer (confounders) som man vet påverkar mamma- och barnutfall är framför allt flerbörd, mammans ålder, och om man tidigare fött barn eller inte (paritet) [45] [46] [47] [48] [49]. Flerbörd är den viktigaste störfaktorn, eftersom flerbörd är associerat med för tidig födsel och lågviktighet och därmed ökad sjuklighet för barnen och mamman [46]. Komplikationer som inte särredovisades för barn födda i enkelbörd, utan där även tvillingar ingick i resultatet, uteslöts därför på grund av oacceptabelt hög risk för bias. Även ålder och paritet är välkända störfaktorer, där äldre mammor och förstföderskor drabbas av fler komplikationer för både mor och barn [46] [47] [48] [49]. Risk för bias bedömningarna påverkades av om dessa störfaktorer inte redovisades eller inte togs hänsyn till i analyserna. Bedömningarna påverkades också av om det var oklart eller skilde sig mellan grupperna i andel färska respektive frysta embryon som återfördes eller dagen i embryoutvecklingen (dag 2–3 eller dag 5–6) vid återförandet. Skillnad i embryostadium vid återföring av embryon har enbart beaktats för några specifika komplikationer, placenta previa och monozygota tvillingar, eftersom dessa utfall är associerade med återförande av blastocyster [50]. Däremot är färska eller frysta embryon av större betydelse för mamma och barnutfall [51]. Hur mycket olika typer av komplikationer är associerade med de olika störfaktorerna bedömdes utifrån sakkunnigas kunskap kring vad som är känt om vilka parametrar som är associerade med olika typer av komplikationer och redovisas i Appendix 8.
I Appendix 2 redovisas studier som uteslöts i sin helhet på oacceptabelt hög risk för bias. Observera att det i de studier som inkluderats efter risk för bias bedömningarna kan finnas enskilda utfall som har uteslutits från analyserna på grund av oacceptabelt hög risk för bias (Appendix 4).
3.2.3 Syntes
Information om studierna, utfallen och resultaten extraherades från alla inkluderade studier med låg, måttlig eller hög risk för bias och detta finns sammanställt i en tabell (Appendix 5). Tabellen sammanställdes av en projektdeltagare och granskades av en annan projektdeltagare.
Vid syntesen sammanvägdes resultaten från de inkluderade studierna. Avsikten var att i första hand använda metaanalyser. För att vi skulle kunna göra metaanalyser krävdes att studieupplägget bedömdes vara tillräckligt lika och att vi bedömde att i stort sett alla relevanta studier för utfallet har inkluderats i översikten. När det inte gick att genomföra en metaanalys gjordes en syntes utan metaanalys. Förutsättningarna för att ta fram ett sammanvägt resultat för komplikationer var att minst tre studier hade redovisat utfallet på ett likartat sätt.
En subgruppsanalys för äldre kvinnor gjordes eftersom äldre kvinnor har fler aneuploida embryon [52] och därför teoretiskt skulle kunna ha en större nytta av PGT-A. Åldern för subgruppen äldre kvinnor baserades på vilka åldersgrupper som redovisades i de inkluderade studierna. Vi hade även planerat att göra subgruppsanalyser för kvinnor med upprepade misslyckade IVF-behandlingar och upprepade missfall, men detta var inte möjligt utifrån de inkluderade studierna.
3.2.3.1 Metaanalyser
Metaanalyserna utfördes i Cochrane’s Review Manager (RevMan) [53]. Vi använde genomgående den så kallade random effects modellen (slumpeffektmodellen) som utgår ifrån att reella skillnader mellan studier också påverkar effekten i dem. I vårt fall handlar det om skillnader i patientpopulationernas karakteristika och skillnader i hur IVF och PGT-A behandlingarna lagts upp. För viktning av studierna använde vi metoden Mantel-Haenszel [54]. Konfidensintervallen räknades ut med Wald-typ metoden [54].
Samtliga utfallsmått var dikotoma (en händelse har antingen inträffat eller inte). Det sammanvägda resultatet anges både som den relativa skillnaden mellan grupperna, uttryckt som oddskvot (engelska: odds ratio, OR) och absoluta skillnaden mellan grupperna, riskskillnaden (engelska: risk difference, RD). Oddskvoten var det utfallsmått som vi i första hand utgick ifrån. För alla metaanalyser beräknades konfidensintervall på 95 procent vilket vanligen används som gränsvärden för att bedöma statistisk signifikans för en skillnad mellan jämförelsegrupperna.
Både inom professionen och hos patienter och allmänheten finns olika uppfattningar om vad en betydelsefull skillnad är vad gäller andelen förlossningar med levande barn. I de fall då vi uttalat oss om att det är en jämförbar effekt mellan jämförelsegrupperna har vi därför utgått från den beräknade effektstorleken och konfidensintervallet för att bedöma risken för att det i verkligheten är en skillnad mellan grupperna och hur stor den skillnaden i så fall skulle vara. Vi har även gjort känslighetsanalyser där varje enskild studie uteslutits en i taget för att ta reda på hur känsligt resultatet är för små förändringar [36]. I de fall resultatet i någon känslighetsanalys ändrats från en statistiskt signifikant till en icke statistiskt signifikant skillnad eller tvärtom har detta vägts in i bedömningen av resultatets tillförlitlighet.
I vissa studier inkluderades graviditeter och förlossningar som skedde spontant utan IVF-behandling i resultatet [55] [56] och i andra studier uteslöts dessa. För att få data så jämförbara som möjligt har vi tagit bort spontana graviditeter och förlossningar i samtliga studier. I Wang och medarbetare från år 2022 [55] var det otydligt hur många som genomfört en embryoåterföring i PGT-A gruppen (224 eller 250). Då kontakt med författarna inte resulterat i något svar har vi utgått ifrån ett av värdena (224). Varken hanteringen av spontana graviditeter eller valet för Wang och medarbetare från år 2022 har påverkat resultaten i våra metaanalyser.
3.2.3.2 Syntes utan metaanalys
Resultat som inte ansetts lämpliga att sammanväga i en metaanalys har beskrivits separat för varje enskild studie. En sammanvägning av resultaten, i en så kallad syntes utan metaanalys, har gjorts i de fall då utfallen redovisats på ett likartat sätt.
Resultaten för de perinatala komplikationerna som projektgruppen bedömt vara mest relevant samt de komplikationer för den gravida kvinnan som vi inkluderat i översikten sammanvägdes med hjälp av rösträkning baserad på effektens riktning (”vote counting based on direction of effect”) [57]. Med denna metod anges för varje studie vilken av jämförelsegrupperna som har den högsta andelen patienter med utfallet. Därefter jämförs hur många studier som har ett resultat som lutar åt att det är en högre andel patienter med utfallet i den ena respektive den andra jämförelsegruppen. Utgångspunkten är riktningen på effekten och inte om det är några statistiskt signifikanta skillnader.
Resultatet för varje enskild studie redovisas i Appendix 7. I första hand valdes justerade resultat vid bedömningen av riktningen på effekten. Punktestimatets riktning, till exempel för en justerad oddskvot, avgjorde om studien ansågs visa på en högre andel för PGT-gruppen eller kontrollgruppen. I andra hand valdes ojusterade resultat om de hade en godtagbar risk för bias. Andelen patienter med utfallet i respektive grupp avgjorde riktningen på effekten för ojusterade resultat. Enbart om punktestimatet var 0,00 eller 1,00 eller om andelen var exakt lika i grupperna (med två decimaler) angavs ingen riktning på effekten för studien. Dessa studier inkluderades inte i beräkningen av effektens riktning.
För att visa på om en statistiskt signifikant skillnad i andelen studier med en viss riktningen på effekten förelåg gjordes ett tvåsidigt statistiskt test av den binomiella fördelningen mellan studierna (Sign test). Enbart studier som angav en riktning på effekten inkluderades i dessa beräkningar. Gränsen för ett statistiskt signifikant resultat sattes till <0,05.
I de fall flera artiklar beskrev samma utfallsmått från samma population (samma klinik eller register under överlappande tidsperiod) redovisas endast resultat för den artikel som inkluderade den största populationen för att undvika att samma individer ingår flera gånger i resultaten. När flera olika interventions och/eller kontrollgrupper redovisades i en artikel och resultaten inte kunde slås ihop redovisades jämförelserna separat [58] [59]. Om det inte gick att välja vilken interventionsgrupp som skulle jämföras mot vilken kontrollgrupp uteslöts artikeln från resultatredovisningen [60].
3.2.4 Bedömning av de sammanvägda resultatens tillförlitlighet
Till sist bedömdes hur tillförlitligt det sammanvägda resultatet var för varje utfall. SBU använder GRADE för att värdera tillförlitligheten [61]. Graden av tillförlitlighet klassificeras som hög, måttlig, låg eller mycket låg.
Innebörden av de olika domänerna som bedöms och de olika nivåerna av tillförlitlighet finns i Faktaruta 3.1. En utförligare beskrivning finns i SBU:s metodbok [36].
3.3 Metod för undersökningar av hälsoekonomiska aspekter
Syftet med det hälsoekonomiska avsnittet är att ställa effekterna i form av påverkan på sannolikheten för förlossning med levande barn från projektets metaanalyser i relation till kostnader för behandling och kliniska utfall. De hälsoekonomiska aspekterna av IVF med PGT-A jämfört med endast IVF undersöks i två delar: en systematisk litteraturöversikt av hälsoekonomisk litteratur, och modellanalyser (genomförda av SBU) som bygger på resultaten av den systematiska översikten gällande effekter och svenska data om IVF-behandling och kostnader. Förutom att möjliggöra analyser i ett svenskt sammanhang, tydliggör modellanalysen hur olika parametrar påverkar kostnadseffektiviteten, samt möjliggör beräkning av kostnadseffektiviteten för olika grupper av kvinnor. Metoderna för de olika delarna beskrivs närmare i följande avsnitt.
3.3.1 Litteraturöversikt
Den hälsoekonomiska översikten utgick från samma population (P), intervention (I) och kontrollgrupp (C) som PICO 1 i projektet (effekt av PGT-A på fertilitetsbehandlingen). De hälsoekonomiska utfallsmåtten av intresse inkluderade kostnader, resursförbrukning, och kostnad per effekt. Relevanta studietyper var jämförande kostnadsanalyser och ekonomiska utvärderingar (modellstudier eller empiriska studier).
3.3.1.1 Process för urval och granskning av studier
En sökning av hälsoekonomisk litteratur genomfördes i samarbete med projektets informationsspecialist (Appendix 1). Sökningen gjordes i databaserna Medline, EMBASE och Cochrane Library, med användning av sökfiltret från National Health Services Economic Evaluation Database (NHS EED). Dessutom genomsöktes Database of Abstracts of Reviews of Effects (DARE) och NHS EED, via CRD Database samt International HTA database. Sökningen genomfördes i februari år 2024 och uppdaterades i november samma år. Innan publicering kontrollerades att ingen av de publikationer som inkluderats i rapporten hade dragits tillbaka, exempelvis på grund av oegentligheter eller forskningsfusk.
En hälsoekonom och en projektledare gallrade studierna baserat på titel och artikelsammanfattning utifrån urvalskriterierna i Covidence (oberoende av varandra). En hälsoekonom och en projektledare bedömde relevansen för inkluderade artikelsammanfattningar i fulltext.
Studier som bedömdes som relevanta efter fulltextgranskningen kvalitetsgranskades av två hälsoekonomer, oberoende av varandra. Granskningen gjordes med hjälp av SBU:s mall för hälsoekonomiska modellstudier som fokuserar på kvalitet avseende hälsoekonomisk metod och överförbarhet av resultaten till svenska förhållanden [62]. Eftersom IVF med PGT-A inte är tillåtet i Sverige i dagsläget, fokuserade bedömningarna enbart på kvalitet och inte på överförbarhet. Bedömningarna sammanfattas som låg, medelhög eller hög kvalitet på den ekonomiska analysen. Artiklar som bedömdes ha låg kvalitet uteslöts från redovisningen i det hälsoekonomiska kapitlet; om kvaliteten bedömdes som låg till medelhög inkluderades artiklarna.
3.3.1.2 Syntes
Resultaten av den hälsoekonomiska litteraturöversikten redovisas i beskrivande text (Kapitel 7) och detaljerade resultattabeller (Appendix 9). Alla kostnadsuppgifter från litteraturen är omräknade till svenska kronor med den valutakurs som rådde det år som kostnadsuppgifterna i studierna är presenterade.
3.3.2 Modellanalys
För att analysera kostnadseffektiviteten av IVF med PGT-A jämfört med enbart IVF i ett svenskt sammanhang konstruerades en hälsoekonomisk modell. Modellen är ett verktyg för att genomföra en kostnadseffektivitetsanalys (Faktaruta 3.2) och syftar till att belysa ett beslutsproblem utifrån bästa tillgängliga information. För detta projekt baseras modellen på data från den systematiska översikten, svenska registerdata för IVF-behandling och svenska kostnadsdata. Resultatet från analysen ges i termer av de kostnader och effekter som respektive behandling medför.
3.3.2.1 Modellstruktur för hälsoekonomisk utvärdering
Modellen skapades som ett beslutsträd i Excel och utgår ifrån beslutet att en kvinna som ska genomgå IVF kan genomgå enbart IVF alternativt IVF med PGT-A. Populationen omfattar kvinnor där PGT-A kan vara relevant för att selektera fram ett optimalt embryo, vilket innebär att kvinnorna antas ha minst två blastocyster (embryon dag 5–6) tillgängliga. Modellens struktur visar de kliniska händelseförlopp som är möjliga för respektive behandlingsalternativ vid den första planerade embryoåterföringen (Figur 3.1). I analysen beräknas förväntade kostnader i relation till andelen kvinnor med en förlossning med levande barn för IVF med respektive utan PGT-A. Kostnaderna omfattar kostnaden för IVF-behandling med eventuellt tillägg av PGT-A, samt kostnader relaterade till graviditet, missfall och förlossning. Graviditet, missfall och förlossning vägs in i beräkningarna utifrån deras sannolikhet att inträffa eftersom de kan påverkas av användningen av PGT‑A. Vi gjorde ett antagande om att det inte skulle finnas någon skillnad i komplikationer och inkluderade därför inte dessa i modellen.
Den hälsoekonomiska modellstrukturen visas i figuren nedan (Figur 3.1). Vid behandling med IVF i kombination med PGT-A (motsvarande cirkeln med ”1” i figuren) sker antingen återföring av ett embryo där PGT-A testet indikerat att embryot inte har ett avvikande antal kromosomer (embryo med euploidi), alternativt återförs inget embryo. Vid behandling med enbart IVF (motsvarande cirkeln med ”2” i figuren) görs antingen återföring av ett embryo där den morfologiska bedömningen av utseendet visar att det finns ett återförbart embryo, alternativt återförs inget embryo. Därefter följer samma händelseförlopp för båda behandlingsalternativen. En återföring kan resultera i en graviditet, alternativt ingen graviditet (efter cirklarna numrerade 3 respektive 4). En graviditet kan i sin tur leda till antingen ett levande fött barn eller missfall (efter cirklarna numrerade 5 respektive 6). Vid graviditet finns även sällsynta händelser som inducerad abort, ektopisk graviditet eller intrauterin fosterdöd. Eftersom sannolikheten för dessa händelser är låg, inkluderas de i den hälsoekonomiska modellen bland missfallen.
De hälsoekonomiska analyserna genomförs för den första planerade embryoåterföringen, vilket motsvarar ungefär en ettårig tidshorisont. Eftersom det är svårt att fånga alla återföringar från ett ägguttag inom tidsramen för kliniska studier, är den första planerade embryoåterföringen en vanlig tidsram för en hälsoekonomisk utvärdering. Analyserna inkluderar endast direkta medicinska kostnader, eftersom den systematiska översikten fokuserar på de medicinska aspekterna av olika utfall. Beräkningarna kan göras för två populationer. I grundscenariot inkluderas kvinnor i alla åldrar som är aktuella för IVF där PGT‑A är ett alternativ; i en subgruppsanalys inkluderas endast kvinnor som är minst 35 år.
Följande inputdata togs fram för modellen:
- Sannolikheter för graviditet och förlossning med levande barn vid IVF-behandling (motsvarande kontrollgrupperna i de kliniska studierna) – dessa baseras på data från Nationella kvalitetsregistret för assisterad befruktning i Sverige [28]. Sannolikheterna presenteras i Avsnitt 3.3.2.2.
- Relativa risker för graviditet och förlossning med levande barn vid tillägg av PGT‑A – dessa baseras på resultaten i Kapitel 5. De relativa riskerna presenteras i Avsnitt 3.3.2.3 och Appendix 10.
- Sannolikhet för embryoåterföring – dessa baseras på data från det Nationella kvalitetsregistret för assisterad befruktning (QIVF) och de inkluderade effektstudierna. Dessa sannolikheter presenteras i Avsnitt 3.3.2.4.
- Kostnadsdata har hämtats från Socialstyrelsens NordDRG, prislistor och sakkunniga. Kostnadsdata presenteras i Avsnitt 3.3.2.5.
3.3.2.2 Sannolikheter för graviditet och förlossning med levande barn vid IVF-behandling
Data om utfall vid IVF-behandling i Sverige har hämtats från Nationella kvalitetsregistret för assisterad befruktning (Q-IVF). Rapportering till registret har pågått sedan år 2007 och görs av såväl offentliga som privata kliniker i Sverige. Så gott som samtliga av landets kliniker deltar i registret, och dataöverföring sker regelbundet [2].
Tabell 3.2 sammanfattar data uttagna från registret, där populationen är vald så att den liknar patienterna i de kliniska studierna för effekter (Figur 3.1). Eftersom användningen av PGT‑A inte är relevant för alla patienter som genomgår IVF gjordes följande urval: data avser cykler där minst två blastocyster utvecklats, patienter som fått återföring dag 5 eller 6 (dvs. inga återföringar dag 2 eller 3) och inkluderar både färska och frysta embryoåterföringar. Endast patienter som använt egna ägg och spermier ingår. Alla åldrar är inkluderade. Första embryoåterföring är i uttaget definierat som den första återföringen de närmaste sex månaderna efter varje ägguttag. En patient som har gjort flera ägguttag kan därmed bidra med data i analysen i flera omgångar.
Data baseras på en femårsperiod för att få ett större underlag till beräkningarna och är uttagna för åren 2018–2022 för att säkerställa avslutad registrering. Varje återföring har följts upp avseende klinisk graviditet, missfall, dödföddhet och förlossning med levande barn.
Bland patienter med ett ägguttag som resulterade i minst två blastocyster blev 51 procent gravida efter den första embryoåterföringen när alla åldrar inkluderades, jämfört med 45 procent för kvinnor 35 år och äldre. Bland de som blev gravida efter första embryoåterföringen var det 83 procent som födde ett levande barn i hela gruppen, jämfört med 78 procent för kvinnor 35 år och äldre. Andelen som fick missfall under en graviditet var 16 respektive 21 procent. I tabellen visas även andelen med ektopisk graviditet och dödfött barn; sammantaget var andelen med dessa utfall omkring 1,5 procent bland gravida oavsett ålder.
| Patienturval och kliniska händelser | Alla åldrar |
35 år och äldre |
|||||
|---|---|---|---|---|---|---|---|
| Antal | Andel | Antal | Andel | ||||
| Ägguttag resulterande i minst två blastocyster (färska + frysta) | 8 862 | 100,0 % | 3 273 | 100,0 % | |||
| Kliniska graviditeter efter första embryoåterföringen i urvalet | 4 527 | 51,1 % | 1 465 | 44,8 % | |||
| Förlossning med levande barn bland de som blir gravida efter första embryoåterföringen i urvalet* | 3 757 | 83,0 % | 1 140 | 77,8 % | |||
| Missfall bland kliniska graviditeter efter första embryoåterföringen i urvalet** | 702 | 15,5 % | 304 | 20,8 % | |||
| Ektopisk graviditet | 20 | 0,4 % | 8 | 0,5 % | |||
| Dödfött barn | 48 | 1,1 % | 13 | 0,9 % | |||
| *I kliniska studier redovisas förlossning med levande barn per embryoåterföring, vilket motsvarar 42,4 % respektive 34,8 %. **inkluderar enstaka inducerade aborter |
|||||||
3.3.2.3 Relativa risker för graviditet och förlossning med levande barn vid tillägg av PGT‑A
Sannolikheterna för graviditet och förlossning med levande barn vid tillägg av PGT‑A baserades på sannolikheterna för IVF i kombination med riskkvoter (relativa risker) från den systematiska översikten. Relativa risker för missfall används inte, eftersom andelen missfall i modellen bestäms av andelen levande barn (alla gravida får antingen en förlossning med levande barn eller ett missfall, så summan av andelarna behöver vara 100 procent). Den relativa risken för förlossning med levande barn från den systematiska översikten användes under förutsättningen att tillförlitligheten till resultatet bedömdes vara låg, måttlig eller hög enligt GRADE.
Resultaten efter IVF kan mätas vid olika tidpunkter och för olika uppföljningstider (Avsnitt 2.1.3). För att kunna modellera skillnaderna i andelen graviditeter och förlossningar med levande barn mellan jämförelsegrupperna användes resultaten per genomförd embryoåterföring. Sannolikheten för förlossning med levande barn är i hög grad relaterad till sannolikheten att bli gravid, vilket innebär att de relativa riskerna för dessa händelser inte kan ändras oberoende av varandra i känslighetsanalyser. Därför användes resultaten för graviditeter per genomförd embryoåterföring oavsett tillförlitligheten till resultatet enligt GRADE.
Data kring antaganden för ingående data i modellen finns detaljerade i Bilaga 10.
3.3.2.4 Sannolikhet för embryoåterföring
Tillägg av PGT‑A innebär att färre embryon kan komma att bedömas ha tillräckligt god kvalitet för återföring jämfört med endast morfologisk bedömning. Sannolikheten för embryoåterföring skiljer sig därmed mellan IVF med och utan PGT‑A.
För IVF-armen baserades sannolikheten för embryoåterföring på data från Q-IVF för alla cykler där minst två blastocyster utvecklats (Avsnitt 3.3.2.1), vilket validerades genom ett stickprov från en av de större deltagande klinikerna (Sahlgrenska universitetssjukhuset). Analyserna visade att i stort sett alla cykler där två blastocyster utvecklades hade möjlighet att få en embryoåterföring. Ibland inträffar dock händelser som gör att en embryoåterföring blir inaktuell, till exempel spontana graviditeter, separationer eller misslyckade upptiningar. Därför antog vi i samråd med sakkunniga och i nivå med publicerade studier [56] [63] [64] [65] att en procent av cykler där två blastocyster utvecklats inte får någon embryoåterföring.
För IVF med PGT‑A baserades information om andelen som inte hade något embryo med euploidi som kunde återföras på de inkluderade effektstudierna. Bara de studier som enbart inkluderade patienter med minst två blastocyster och som biopserade fler än ett embryo användes för dessa beräkningar [56] [63] [65] . Andelen som inte hade ett embryo med euploidi som kunde återföras (6 %) adderades sedan till andelen som inte fick en återföring från IVF-armen (1 %) för att få en uppskattning av den totala andelen som inte får en återföring vid PGT‑A i de fall då två blastocyster utvecklats. I nedanstående tabell visas sannolikheterna som används i modellen för en embryoåterföring beroende på behandling.
| Behandling | Andel kvinnor med minst 2 blastocyster som inte får en embryoåterföring | Andel kvinnor med minst 2 blastocyster med en genomförd embryoåterföring | Källa |
|---|---|---|---|
| Vid sedvanlig IVF-behandling | 1 % | 99 % | QIVF, sakkunniga |
| Vid IVF med PGT‑A* | 7 % | 93 % | [56] [63] [65] |
| *Dessa studier inkluderad främst yngre kvinnor: 20-37 år [56], 21–42 år [65] samt 25–40 år [63]. Bland kvinnor 35 år och äldre kan andelen med minst 2 blastocyster som får en embryoåterföring förväntas vara lägre än det generella genomsnittet. | |||
3.3.2.5 Kostnader
Kostnaden för IVF-behandlingen sattes till 45 800 svenska kronor baserat på Karolinska sjukhusets utomregionala prislista [66]. I denna kostnad ingår ett nybesök, stimulering, odling och en embryoåterföring.
Denna kostnad uppstår alltid vid IVF-behandling, om PGT‑A utförs tillkommer en extra kostnad. Denna extra kostnad för PGT‑A (biopsering av embryot och genetisk analys av cellerna) beräknades till i genomsnitt 37 500 svenska kronor baserat på data från Karolinska och Sahlgrenska universitetssjukhusen samt diskussioner med sakkunniga. I dagsläget genomförs PGT endast på dessa två kliniker i Sverige. Uppskattningarna utgår ifrån att fyra embryon biopseras i genomsnitt. Kostnader för den form av genetisk analys som skulle komma att göras vid PGT‑A motsvarar analys av alla embryon från ett ägguttag. Den upparbetning av det genetiska materialet som i nuläget krävs för varje patient vid PGT‑M och PGT‑SR blir däremot inte aktuell. Tabell 3.4 visar kostnaderna för biopsi och analys från Karolinska Universitetssjukhuset och Sahlgrenska Universitetssjukhuset som ligger till grund för medelvärdet i modellen.
| Kostnadsdelar | SEK | Källa och antaganden |
|---|---|---|
| ICSI= intracytoplasmatisk spermieinjektion; IVF= in vitro fertilisering; PGD= preimplantatorisk genetisk diagnostik; PGT-A= preimplantatorisk genetisk testning för aneuploid; SEK= svenska kronor. |
||
| Karolinska Universitetssjukhuset | ||
| Embryobiopsi | 13 403 | Utomregional prislista 2024.Uträknad som kostnad för PGD-behandling med IVF/ICSI (59 210 SEK) minus kostnaden för vanlig IVF/ICSI (45 807 SEK). |
| Embryoanalys – Klinisk genetik, per ägguttag | 26 061 | Prislista 2023, uppräknat med 2,2 % för 2024 års priser.Utan upparbetning eller extra besök. |
| Total kostnad PGT‑A + biopsi | 39 464 | |
| Sahlgrenska Universitetssjukhuset | ||
| Embryobiopsi | 14 470 | Uträkning av sakkunnig.Inkluderar upptining och preparation för analys, för 4 embryon. |
| PGT‑A analys, klinisk genetik | 21 000 | Uppgift från Klinisk Genetik Sahlgrenska.Oavsett antal embryon. |
| Total kostnad PGT‑A + biopsi | 35 470 | |
I en hälsoekonomisk utvärdering tas alla kostnader med som kan påverkas av en insats, vilket i den här utvärderingen omfattar kostnaderna för de händelser som visas i Figur 3.1. Kostnaden för standarduppföljning under graviditet baserades på information från 1177 [67]. Utifrån ett spann på 6–10 barnmorskebesök under en graviditet utan komplikationer gjordes ett antagande om att en kvinna i genomsnitt går på åtta besök när en graviditet konstaterats efter IVF. Antalet besök multiplicerades med DRG-kostnaden (kostnaden per diagnosrelaterad grupp) för ett barnmorskebesök [68]. Totalkostnaden för standarduppföljning under graviditet skattades därmed till omkring 20 400 svenska kronor.
Den medicinska kostnaden relaterad till födseln av ett levande barn baserades på ett medelvärde för okomplicerade vaginala förlossningar (utifrån att dessa kan anses mest vanliga) respektive kejsarsnitt, viktat med frekvensen av de två förlossningssätten [68]. Enligt statistik från Socialstyrelsen [69] sker 19,5 procent av förlossningar genom kejsarsnitt i Sverige. Kostnaden för ett missfall baserades på DRG-kostnaden för ”extrauterin graviditet och missfall” i öppenvård [68].
Följande tabell (Tabell 3.5) listar koderna och kostnaderna för de kliniska händelserna i modellen som baseras på Socialstyrelsens NordDRG.
| SEK = svenska kronor. Källa: Socialstyrelsen NordDRG 2025 |
|||
| Kostnadspost | DRG-kod | Kostnad (SEK) | |
|---|---|---|---|
| Barnmorskebesök, öppenvård | Y86O | 2 554 | |
| Vaginal förlossning, inte komplicerad | P05E | 48 962 | |
| Kejsarsnitt, inte komplicerat | P01E | 90 967 | |
| Missfall, öppenvård | P20O | 4 579 | |
Tabell 3.6 nedan visar de slutliga kostnaderna som används i den hälsoekonomiska modellen, inklusive kostnaderna för IVF-behandling med PGT‑A. Eftersom det förekommer viss variation i kostnader mellan kliniker har kostnaderna avrundats till närmaste hundratal.
| Kostnader i modellen | SEK | Kommentar |
|---|---|---|
| PGT‑A, inklusive embryobiopsi | 37 500 | PGT‑A analysen görs per ägguttag |
| IVF-behandling | 45 800 | Inkluderar 1 återföring och 1 ultraljud |
| Graviditet standarduppföljning | 20 400 | Antar 8 besök hos barnmorska |
| Missfall | 4 600 | Inga barnmorskebesök innan missfallet antas, eftersom de flesta missfallen sker tidigt |
| Förlossning | 57 200 | Viktat medel (19,5 % kejsarsnitt) |
3.3.2.6 Känslighetsanalyser
I nedanstående tabell sammanfattas känslighetsanalyserna (Tabell 3.7). Känslighetsanalyserna fokuserar på variation av kostnader och relativa risker utifrån olika antaganden. Analyserna görs för att kunna bedöma hur känsligt resultatet är för förändringar i de olika parametrarna.
| Parameter | Känslighetsanalyser |
|---|---|
| Patientgrupp | Grundscenario: alla åldrar Subgruppsanalys: kvinnor 35 år och äldre |
| Kostnader | Känslighetsanalys: Variation med +/-20 % |
| Relativa risker för levande födda barn och graviditeter | Alla åldrar respektive kvinnor 35 år och äldre: Variation med +/-10 % (skattat utifrån konfidensintervallet för relativa risken för huvudresultatets punktestimat, se Appendix 10) Variation med +/-5 % Variation med +/-1 % |
3.4 Metod för brukarsamverkan
I projektet har samverkan skett dels med en brukarförening som representerar patienter som kan tänkas vilja göra IVF med PGT‑A, Riksförbundet ofrivillig barnlöshet, dels två brukarföreningar som representerar individer med kromosomavvikelser, Svenska Downföreningen och Riksförbundet FUB (för barn och unga med intellektuell funktionsnedsättning). Brukarföreningarna informerades om projektet och fick möjlighet att lämna synpunkter på våra frågeställningar och urvalskrav innan projektplanen fastställdes. I ett senare skede hölls möten med brukarföreningarna där de fick möjlighet att lämna synpunkter på etiska aspekter som de anser är viktiga att beakta. Slutligen fick brukarföreningarna möjlighet att lämna synpunkter på rapportens kapitel om etiska aspekter.
3.5 Metod för att undersöka etiska aspekter
En etiker ingick som sakkunnig i projektgruppen och ledde arbetet med att identifiera etiska aspekter av relevans i ett svenskt sammanhang förknippade med PGT‑A vid IVF. I enlighet med SBU:s vägledning Etiska aspekter på insatser inom hälso- och sjukvården [70] diskuterade projektgruppen etiska aspekter som spontant framstod som relevanta redan i början av projektet. Vid relevansbedömningen av artiklar från litteratursökningen identifierades sedan kvalitativa studier om PGT‑A vid IVF och litteratur om etiska frågor kopplade till åtgärden. Bland dessa valdes ett antal studier ut för närmare granskning utifrån relevans för projektets etik-frågeställning. Projektgruppens etiker identifierade också kompletterande litteratur om etiska aspekter på PGT‑A vid IVF och assisterad befruktning mer generellt som bedömdes ha bäring på frågeställningen.
Utifrån projektgruppens diskussioner och den identifierade litteraturen formulerades preliminärt ett antal etiska aspekter. Dessa användes som underlag för möten med brukarorganisationerna (Avsnitt 3.4) och kompletterades och nyanserades i ljuset av deras synpunkter.
I en senare fas i projektet skedde en mer utförlig och strukturerad etikdiskussion inom projektgruppen utifrån den uppsättning frågor som beskrivs i SBU:s vägledning [70], vilket ledde till att de redan formulerade etiska aspekterna ytterligare kompletterades och nyanserades.
4 .Urval av studier
4.1 Studier om effekt och komplikationer
Litteratursökningarna för översikten om effekt på hälsa (PICO 1 och 2) resulterade i 9 673 referenser efter att dubbletter hade uteslutits. En referens tillkom vid granskning av referenslistor i relevanta systematiska översikter och inkluderade studier. Efter granskning av artikelsammanfattningar återstod 462 artiklar som granskades i fulltext (Figur 4.1).
Totalt identifierades 11 RCT-studier där effekten av IVF med PGT-A, med de moderna genetiska tekniker som analyserar samtliga kromosomer, jämfördes med IVF utan PGT-A. Två av dessa artiklar beskrev samma RCT-studie, så totalt identifierades 10 RCT-studier. Två av RCT-studierna uteslöts på relevans eftersom studieupplägget var att antalet embryon som återfördes vid en embryoåterföring skulle vara olika i interventions- och kontrollgruppen [71] [72] (Appendix 2). De åtta kvarvarande RCT-studierna (redovisade i nio artiklar) granskades för att avgöra risken för att studiernas resultat påverkats av bias. En av RCT-studierna (redovisad i två artiklar) bedömdes ha oacceptabelt hög risk för bias och uteslöts eftersom processen och tidpunkten för randomiseringen var oklar, skillnader i bortfall mellan grupperna saknade förklaring och protokoll saknades [73] [74] (Appendix 2). Totalt inkluderades sju RCT-studier om effekt i våra analyser [55, 56, 63-65, 75, 76] (Kapitel 5 och Appendix 5).
För frågeställningen om komplikationer identifierades 108 artiklar som uppfyllde våra relevanskrav. Femtiosju studier om komplikationer (7 RCT-studier och 50 icke-randomiserade studier) bedömdes ha en acceptabel risk för bias och inkluderades i rapporten (Kapitel 6 och Appendix 5). Fyrtiofyra studier om komplikationer bedömdes ha en övergripande oacceptabelt hög risk för bias och de uteslöts från analyserna och redovisas i Appendix 2. För majoriteten av studierna om komplikationer som bedömdes ha oacceptabelt hög risk för bias var orsaken att de inte särredovisade resultat för barn födda i enkelbörd.
Tre av de inkluderade studierna uppfyllde kraven för båda frågeställningarna om effekt och komplikationer och bedömdes ha en acceptabel risk för bias [56] [63] [64]. De ingår både i våra analyser av effekt och komplikationer.
I Appendix 2 framgår vilka artiklar som uteslutits på fulltextnivå och vilka som uteslutits på grund av oacceptabelt hög risk för bias, samt orsaken till det.
4.2 Systematiska översikter
Litteratursökningen för systematiska översikter resulterade i 397 referenser. Efter granskning av artikelsammanfattningar återstod 36 systematiska översikter om effekt eller komplikationer som publicerats de fyra senaste åren (år 2020 till 2023). Efter granskning av fulltexter återstod 11 artiklar som kvalitetsbedömdes för att se om de skulle kunna ersätta någon del i den översikt av effekter på hälsa som vi planerade [18, 77-86]. Ingen av översikterna uppfyllde dock våra krav på relevans och tillförlitlighet.
4.3 Studieprotokoll
Sökningen efter studieprotokoll för kliniska studier som utvärderar effekten av IVF med PGT- A resulterade i 704 referenser som publicerats de senaste tio åren (år 2014 till 2024). Efter granskning återstod 52 studieprotokoll, varav 13 var pågående RCT-studier och 10 var RCT-studier som antingen var avbrutna eller där status för studien var oklart.
4.4 Studier om hälsoekonomi
Litteratursökningen för hälsoekonomiska studier resulterade i 1 210 artikelsammanfattningar. En studie tillkom från sökningen för översikten om effekter på hälsa. Efter granskning av artikelsammanfattningar och fulltexter återstod 12 artiklar som bedömdes uppfylla våra inklusionskriterier (Figur 4.2). I Appendix 2 framgår vilka artiklar som uteslutits på fulltextnivå, samt orsaken till det.
De hälsoekonomiska studierna granskades för att bedöma kvalitet av den hälsoekonomiska metoden. Av de 12 studierna bedömdes 10 ha låg kvalitet och uteslöts från resultaten. Dessa redovisas i Appendix 2. Generellt bestod bristerna i analys och rapportering, mer detaljerade orsaker till att studierna uteslöts beskrivs i Kapitel 7.
5. Resultat: effekt av PGT-A vid IVF
Detta kapitel inleds med en övergripande sammanfattning av resultaten för effekt av PGT‑A (Avsnitt 5.1) följt av en beskrivning av studierna som ingår i översikten (Avsnitt 5.2). Därefter beskrivs resultaten för de primära utfallsmåtten relaterade till andelen förlossningar med levande barn för alla kvinnor som randomiserats till någon av jämförelsegrupperna (ITT-analys) (Avsnitt 5.3). I Avsnitt 5.4 beskrivs resultaten för de sekundära utfallsmåtten. Vi har även redovisat resultatet för kvinnor 35 år och äldre (Avsnitt 5.5) eftersom äldre kvinnor har fler aneuploida embryon och därför teoretiskt skulle kunna ha en större nytta av PGT‑A.
5.1 Sammanfattning av resultaten
Primära utfall
- Andel förlossningar med levande barn är jämförbar för de som genomgår en IVF-behandling med eller utan PGT‑A (låg tillförlitlighet). Detta gäller per randomiserad kvinna (ITT-analys), både då den första planerade embryoåterföringen utvärderas och då samtliga embryoåterföringar från ett ägguttag utvärderas.
- Även för kvinnor 35 år och äldre är andelen förlossningar med levande barn per randomiserad kvinna (ITT-analys) jämförbara för de som genomgår en IVF-behandling med eller utan PGT‑A (låg tillförlitlighet). Dock går det inte att bedöma om ett av de primära utfallsmåtten, andelen förlossningar med levande barn efter den första planerade embryoåterföringen, påverkas för denna grupp eftersom resultatet är mycket osäkert (mycket låg tillförlitlighet).
Sekundära utfall
- Då enbart kvinnor med en genomförd embryoåterföring analyseras ses högre andel förlossningar med levande barn för de som genomgått IVF med PGT‑A (låg tillförlitlighet). Detta gäller även för kvinnor 35 år och äldre.
- Det går inte att bedöma om andelen missfall per klinisk graviditet påverkas av IVF med PGT‑A, varken för hela populationen eller för kvinnor 35 år och äldre eftersom resultatet är mycket osäkert (mycket låg tillförlitlighet).
- Det vetenskapliga underlaget för den totala behandlingstiden till förlossning var otillräckligt och kunde inte sammanvägas då det bestod av för få studier som dessutom hade undersökt utfallet på olika sätt.
Totalt identifierade vi tio RCT-studier som utvärderar effekten av IVF med PGT‑A med de moderna genetiska tekniker som analyserar samtliga kromosomer, men tre studier uteslöts eftersom de inte uppfyllde våra krav gällande relevans eller risk för bias (Kapitel 4). I vår översikt ingår därför sju RCT-studier som redovisar resultat för effekten av IVF med PGT‑A och flera av våra utfallsmått redovisas bara i några av studierna. Att det är så få studier har påverkat vår bedömning av tillförlitligheten till resultaten i de fall då känslighetsanalyser där enstaka studier uteslutits ändrat resultatet från en statistiskt signifikant till en icke statistiskt signifikant skillnad, eller tvärtom. Även brister i upplägget på flera av de inkluderade studierna har påverkat tillförlitligheten till resultatet.
| Utfall | Resultat | GRADE-bedömning |
|---|---|---|
| Förlossningar med levande barn | ||
| Sammantaget mått för de som genomgår en IVF-behandling (ITT-analys) |
||
| Oavsett ålder 35 år och äldre |
Jämförbar effekt Jämförbar effekt |
|
| Efter den första planerade embryoåterföringen (ITT-analys) |
||
| Oavsett ålder 35 år och äldre |
Jämförbar effekt Går inte att bedöma |
|
| Samtliga embryoåterföringar från ett ägguttag (ITT-analys) |
||
| Oavsett ålder 35 år och äldre |
Jämförbar effekt Jämförbar effekt |
|
| För de med en genomförd embryoåterföring | ||
| Oavsett ålder 35 år och äldre |
Större andel efter PGT‑A Större andel efter PGT‑A |
|
| Missfall per klinisk graviditet | ||
| Oavsett ålder 35 år och äldre |
Går inte att bedöma Går inte att bedöma |
|
| ITT = Intention to treat; IVF; in vitro-fertilisering; PGT‑A = Preimplantatorisk genetisk testning för aneuploidi |
||
5.2 Beskrivning av ingående studier
I sju randomiserade kontrollerade studier med totalt 3 442 deltagare har effekten av IVF med PGT‑A jämförts med IVF utan PGT‑A (Tabel 5.2 och Appendix 5). Två studier inkluderade enbart äldre kvinnor [75] [76], en studie enbart yngre kvinnor [64] och övriga studier inkluderade både äldre och yngre kvinnor (Tabell 5.2). Majoriteten av studiedeltagarna hade inte genomgått tidigare IVF-behandlingar (Tabell 5.2). I en studie fick cirka 5 procent i vardera gruppen donerade ägg [65], i fem studier ingick inte donerade ägg [56, 63, 64, 75, 76] och i en studie angavs det inte [55] (Appendix 5).
IVF-behandlingen och PGT‑A behandlingen varierade i studierna. I majoriteten av studierna hade alla embryon varit frysta innan återföringen till kvinnan [55] [56] [63] [64], men i en studie återfördes enbart färska embryon [65]. Antalet embryon som återfördes per embryoåterföring varierade mellan studierna och även mellan behandlingsgrupperna i vissa studier (Tabell 5.2).
I samtliga studier som inkluderades provtogs embryona för PGT‑A genom en biopsi, inga relevanta studier av PGT‑A med provtagning av vätskan som embryona odlas i identifierades. I fem av studierna togs biopsin på embryona dag 5 efter befruktningen [55, 56, 63-65], i de två andra togs biopsin dag 3 efter befruktningen [75] respektive på polkropparna i det befruktade ägget [76]. I alla studier analyserades samtliga kromosomer, men den genetiska analysmetoden varierade (Tabell 5.2).
Vid PGT‑A biopseras normalt sett alla embryon av morfologiskt god kvalitet från ett ägguttag för att hitta de embryon som har normalt antal kromosomer, men i två av studierna biopserades enbart ett begränsat antal embryon [56] [64]. Även embryon i kontrollgruppen biopserades i två studier [55] [63], men embryon för återföring valdes i dessa fall utifrån morfologi och inte utifrån resultatet av PGT‑A analysen. I samtliga sju studier undersöktes effekten av PGT‑A per randomiserad kvinna efter en planerad embryoåterföring [55, 56, 63-65, 75, 76]. I tre studier undersöktes dessutom effekten av flera möjliga embryoåterföringar från ett ägguttag, per randomiserad kvinna [56] [75] [76].
| Studie Referens Land Antal deltagare |
Inkluderad population Kvinnornas ålder Tidigare IVF-behandlingscykler |
Studiens upplägg Embryon som biopserades Antal utvärderade embryoåterföringar per kvinna |
PGT‑A behandlingen Dag för biopsi Genetisk analysmetod |
IVF-behandlingen Andel frysta embryon Antal embryon per återföring |
|---|---|---|---|---|
| Munne et al. 2019 [63] USA, Kanada, UK, Australien N=661 |
25–40 år Max 2 tidigare IVF försök |
I: Alla morfologiskt ok C: Alla utom morfologiskt bästa En embryoåterföring |
Dag 5/6 NGS |
100 % 1 embryo |
| Ozgur et al. 2019 [64] Turkiet N=220 |
≤35 år Cirka 14 % gjort tidigare IVF försök |
I: Morfologiskt bästa C: Inget En embryoåterföring |
Dag 5 NGS |
100 % 1 embryo |
| Rubio et al. 2017 [75] Spanien N=278 |
38–41 år Medel 0,2 tidigare IVF försök |
I: Alla morfologiskt ok C: Inget Alla embryoåterföringar från ett ägguttag som hunnits med 6 månader efter avslutad rekrytering till studien |
Dag 3 aCGH |
0 % vid första embryoåterföringen Totalt: I: 1,4 % C: 26,9 % Medel antal embryon I: 1,3 C: 1,8 |
| Scott et al. 2013 [65] USA N=155 |
21–42 år Medel 0,3 tidigare IVF försök |
I: Alla C: Inget En embryoåterföring |
Dag 5 qPCR CCS |
0 % Medel antal embryon I: 1,9 C: 2,0 |
| Verpoest et al. 2018 [76] 7 länder i Europa + Israel N=396 |
36–40 år Cirka 42 % gjort tidigare IVF försök |
I: Alla C: Inget Alla embryoåterföringar från ett ägguttag som hunnits med efter ett år |
Polkropp (6-9 timmar efter befruktning) aCGH |
0% vid första embryoåterföringen Totalt: I: 14 % C: 30 % Ett embryo I: 59 % C: 23 % |
| Wang et al. 2022 [55] Kina N=520 |
Cirka 40 % <32 år Cirka 35 % >35 år Inte angivet |
I: Alla C: Alla, men val utifrån morfologi En embryoåterföring |
Dag 5/6 NGS |
100 % Ett embryo I: 90,8 % C: 92 % |
| Yan et al. 2021 [56] Kina N=1212 |
20–37 år Inga tidigare IVF försök |
I: De tre morfologiskt bästa C: Inget Upp till tre embryoåterföringar från ett ägguttag |
Dag 5 NGS |
100 % Ett embryo I: 99,2 % C: 97,5 % |
| aCGH = Array Comparative Genomic Hybridisation; C = Control; I = Intervention; IVF = In vitro-fertilisering; NGS = Next Generation Sequencing; PGT‑A = Preimplantatorisk genetisk testing för aneuploidi; qPCR CCS = Quantitative Real-time Polymerase Chain Reaction based Comprehensive Chromosome Screening, teknik som analyserar antalet kopior av embryots alla kromosomer. | ||||
5.2.1 Ingående studiers risk för bias
I Tabell 5.3 redovisas vår bedömning av risk för bias för de ingående studierna. Observera att risken för bias har bedömts för varje enskilt utfall. I metaanalyserna har studierna grupperats utifrån den risk för biasbedömning som gjorts för aktuellt utfall. I Appendix 4 finns en mer utförlig beskrivning av orsaken till bedömningarna.
| Studie | Randomiseringen | Skillnader i behandling | Bortfall | Mätning av utfallen | Rapportering av resultat | Intresse-konflikter | Övergripande |
|---|---|---|---|---|---|---|---|
| Munne et al. 2019 [63] | Låg |
Låg |
Låg |
Låg |
Låg |
Ja | Låg |
| Ozgur et al. 2019 [64] | Låg |
Måttlig |
Hög |
Låg |
Måttlig |
Nej | Hög |
| Rubio et al. 2017 [75] | Måttlig |
Måttliga Högb |
Låg |
Låg |
Lågc Oacceptabeltd |
Ja | Måttliga Höge Oacceptabeltd |
| Scott et al. 2013 [65] | Låg |
Hög |
Låg |
Låg |
Måttlig |
Nej | Hög |
| Verpoest et al. 2018 [76] | Låg |
Måttlig |
Låg |
Låg |
Låg |
Nej | Måttlig |
| Wang et al. 2022 [55] | Hög |
Måttlig |
Låg |
Låg |
Måttlig |
Nej | Hög |
| Yan et al. 2021 [56] | Låg |
Lågf Måttligg |
Låg |
Låg |
Låg |
Nej | Lågf Måttligg |
| a för utfallen förlossning med levande barn / graviditet per planerade embryoåterföring och per genomförd embryoåterföring, missfall och ektopisk graviditet b för utfallen förlossning med levande barn per ägguttag och tid till graviditet / förlossning c för utfallen förlossning med levande barn, graviditet, missfall och ektopisk graviditet d för utfallen tid till graviditet / förlossning e för utfallet förlossning med levande barn per ägguttag f för utfallen förlossning med levande barn / graviditet per planerade embryoåterföring och per genomförd embryoåterföring, missfall och ektopisk graviditet g för utfallen förlossning med levande barn per ägguttag och tid till förlossning |
|||||||
5.3 Sammanvägda resultat för de primära utfallen (ITT-analys)
Vårt primära utfall var andel förlossningar med levande barn per kvinna som randomiserats till att genomgå en IVF-behandling med eller utan PGT‑A i studierna (ITT-analys). Resultatet redovisas dels för den första planerade embryoåterföringen, dels kumulativt för alla embryoåterföringar från ett ägguttag. Eftersom upplägget vad gäller IVF och PGT‑A behandlingen, men även hur resultatet redovisas, skiljer sig mellan studierna har vi valt att även redovisa ett sammantaget utfallsmått för förlossningar med levande barn för de som genomgår en IVF-behandling med eller utan PGT‑A. I det sammantagna utfallet har vi slagit ihop våra två primära utfallsmått. Vi har utgått ifrån resultatet för alla embryoåterföringar från ett ägguttag när det redovisats i studierna och om det saknas, resultatet för den första planerade embryoåterföringen.
5.3.1 Förlossningar med levande barn efter den första planerade embryoåterföringen per randomiserad kvinna
Alla sju studierna med sammanlagt 3 442 deltagare har redovisat andel kvinnor med en förlossning med levande barn efter den första planerade embryoåterföringen [55, 56, 63-65, 75, 76]. Resultaten från de sju studierna vägdes samman i en metaanalys som inte visade någon statistiskt signifikant skillnad i födelsefrekvens mellan grupperna (OR 1,16; 95 %KI 0,94 till 1,45) (Figur 5.1).
Vår bedömning är att efter den första planerade embryoåterföringen är effekten av IVF med eller utan PGT‑A jämförbar vad gäller utfallet andelen förlossningar med levande barn. Tillförlitligheten till resultatet bedöms dock vara låg (![]() ) på grund av risk för bias i de inkluderade studierna samt vissa brister i överensstämmelse mellan studierna och precision i det sammanvägda resultatet (Tabell 5.4).
) på grund av risk för bias i de inkluderade studierna samt vissa brister i överensstämmelse mellan studierna och precision i det sammanvägda resultatet (Tabell 5.4).
5.3.2 Förlossningar med levande barn för samtliga embryoåterföringar från ett ägguttag, per randomiserad kvinna
Tre studier med sammanlagt 1 886 deltagare har redovisat andelen kvinnor med en förlossning med levande barn efter samtliga embryoåterföringar från ett ägguttag [56] [75] [76]. Resultaten från de tre studierna vägdes samman i en metaanalys som inte visade någon statistiskt signifikant skillnad i födelsefrekvens mellan grupperna (OR 0,87; 95 % KI 0,64 till 1,19) (Figur 5.2).
Vår bedömning är att efter samtliga embryoåterföringar från ett ägguttag är effekten av IVF med eller utan PGT‑A jämförbar vad gäller utfallet andelen förlossningar med levande barn. Tillförlitligheten till resultatet bedöms dock vara låg (![]() ) på grund av risk för bias i de inkluderade studierna samt brister i precisionen i det sammanvägda resultatet (Tabell 5.4).
) på grund av risk för bias i de inkluderade studierna samt brister i precisionen i det sammanvägda resultatet (Tabell 5.4).
5.3.3 Sammantaget mått på andel förlossningar med levande barn för de som genomgår en IVF-behandling, per randomiserad kvinna
Alla sju studierna med sammanlagt 3 442 deltagare har redovisat andelen kvinnor med en förlossning med levande barn efter samtliga embryoåterföringar från ett ägguttag eller den första planerade embryoåterföringen [55, 56, 63-65, 75, 76]. Resultaten från de sju studierna vägdes samman i en metaanalys som inte visade någon statistiskt signifikant skillnad i förlossningsfrekvens mellan grupperna (OR 1,02; 95 % KI 0,79 till 1,32) (Figur 5.3).
Vår bedömning är att för de som genomgår en IVF-behandling med eller utan PGT‑A är effekten jämförbar vad gäller utfallet andelen förlossningar med levande barn. Tillförlitligheten till resultatet bedöms dock vara låg (![]() ) på grund av risk för bias i de inkluderade studierna samt bristande överensstämmelse mellan studierna (Tabel 5.4).
) på grund av risk för bias i de inkluderade studierna samt bristande överensstämmelse mellan studierna (Tabel 5.4).
5.3.4 Sammanfattning för de primära utfallen
Andel förlossningar med levande barn förefaller vara jämförbar för de som genomgår en IVF-behandling med eller utan PGT‑A. Detta gäller per randomiserad kvinna både vid utvärdering av den första planerade embryoåterföringen och av samtliga embryoåterföringar från ett ägguttag (Tabell 5.4).
| Utfallsmått | Antal deltagare (Antal studier, Studiedesign) Referens |
Effekt OR och RD (95 % KI) |
Resultat | Tillförlitlighet | Avdrag |
|---|---|---|---|---|---|
| Förlossningar med levande barn efter den första planerade embryoåterföringen | 3 442 (7 RCT) [55, 56, 63-65, 75, 76] |
OR 1,16 (0,94 till 1,45) RD 0,04 (-0,01 till 0,08) |
IVF med och utan PGT‑A har jämförbar effekt | Låg |
Risk för bias (-1)a Överensstämmelseb Precisionb |
| Förlossningar med levande barn efter samtliga embryo:återföringar från ett ägguttag | 1 886 (3 RCT) [56, 75, 76] |
OR 0,87 (0,64 till 1,19) RD -0,03 (-0,08 till 0,03) |
IVF med och utan PGT‑A har jämförbar effekt | Låg |
Risk för bias (-1)c Precision (-1)d |
| Sammantaget mått på andel förlossningar med levande barn för de som genomgår en IVF-behandling | 3 442 (7 RCT) [55, 56, 63-65, 75, 76] |
OR 1,02 (0,79 till 1,32) RD 0,01 (-0,05 till 0,06) |
IVF med och utan PGT‑A har jämförbar effekt | Låg |
Risk för bias (-1)a,c Överensstämmelse (-1)e |
| IVF= In vitro-fertilisering; KI=konfidensintervall; OR= Odds ratio; PGT‑A= Preimplantatorisk genetisk testning för aneuploidi; RCT= randomiserad kontrollerad studie ; RD= Risk difference. a. Majoritet av studierna har hög eller måttlig risk för bias på grund av olika återföringsdagar [65], knapphändig information om randomiseringen och baslinjevärdena [55], enbart resultat för de som följde protokollet [64], återföring av embryon med okänd kromosomuppsättning i PGT‑A gruppen [64] [76] och oklarhet kring randomisering och blindning samt enbart baslinjedata för de som följde protokollet [75]. bVissa brister i överensstämmelse mellan studierna, som till viss del visar motstridiga resultat. Vissa brister i precision på grund av ett relativt brett konfidensintervall som gränsar till statistiskt signifikant skillnad mellan grupperna. Resultatet är dock robust i känslighetsanalyser och studierna med låg risk för bias stödjer det sammanvägda resultatet. Sammantaget ett avdrag med -1. c. Studierna har hög eller måttlig risk för bias för förlossningar med levande barn per ägguttag på grund av kort uppföljningstid [75], begränsat antal embryon [56] och återföring av embryon med okänd kromosomuppsättning i PGT‑A gruppen [76]. d. Få studier och relativt brett konfidensintervall. e. Motstridiga resultat mellan studierna. Studieupplägg och utvärderat utfallsmått skiljer sig mellan studierna. |
|||||
5.4 Sammanvägda resultat för de sekundära utfallen
5.4.1 Förlossningar med levande barn för de med en genomförd embryoåterföring
Här presenteras det sekundära utfallet förlossningar med levande barn för de med en genomförd embryoåterföring. Observera att detta inte är en ITT-analys utan en selekterad analys för bara de kvinnor som efter att de genomgått en IVF-behandling med eller utan PGT‑A hade embryon som kunde återföras.
Alla sju studierna [55, 56, 63-65, 75, 76] har redovisat andelen kvinnor med en förlossning med levande barn för de sammanlagt 3 049 deltagare med en genomförd embryoåterföring. Resultaten från de sju studierna vägdes samman i en metaanalys som visade på en statistiskt signifikant skillnad i födelsefrekvens till fördel för PGT‑A gruppen (OR 1,49; 95 % KI 1,13 till 1,96) (Figur 5.4). Det var nio procentenheter fler förlossningar med levande barn för de med en genomförd embryoåterföring i PGT‑A gruppen (Tabell 5.5).
Vår bedömning är att för de med en genomförd embryoåterföring efter IVF med PGT‑A blir det fler förlossningar med levande barn än efter IVF utan PGT‑A. Tillförlitligheten till resultatet bedöms dock vara låg (![]() ) på grund av risk för bias i de inkluderade studierna samt bristande överensstämmelse mellan studierna (Tabell 5.5).
) på grund av risk för bias i de inkluderade studierna samt bristande överensstämmelse mellan studierna (Tabell 5.5).
5.4.2 Missfall per klinisk graviditet
Missfall redovisas som andelen missfall för alla kliniska graviditeter efter den första embryoåterföringen. Fem studier har redovisat andelen kvinnor som får ett missfall [56, 63, 64, 75, 76]. Totalt ingick 1 515 kvinnor med en klinisk graviditet efter den första embryoåterföringen. Resultaten från de fem studierna vägdes samman i en metaanalys som visade att missfallsfrekvensen per klinisk graviditet var statistiskt signifikant högre i kontrollgruppen (OR 1,73; 95 % KI 1,01 till 2,98) (Figur 5.5). Det var tio procentenheter färre missfall per klinisk graviditet i gruppen som gjort IVF med PGT‑A (Tabell 5.5).
Vår bedömning är att det inte går att avgöra om det är någon skillnad i andel missfall per klinisk graviditet efter IVF med eller utan PGT‑A. Detta eftersom resultatet är mycket osäkert då det ändras från en statistiskt signifikant skillnad till en icke statistiskt signifikant skillnad mellan jämförelsegrupperna då samma data istället grupperas utifrån ålder (Figur 7 i Appendix 6). Resultatet påverkas även då enstaka studier utesluts i känslighetsanalyser. Tillförlitligheten till resultatet bedöms vara mycket låg (![]() ) på grund av risk för bias i de inkluderade studierna samt mycket allvarliga brister i precision för det sammanvägda resultatet (Tabell 5.5).
) på grund av risk för bias i de inkluderade studierna samt mycket allvarliga brister i precision för det sammanvägda resultatet (Tabell 5.5).
5.4.3 Graviditet
Utfallet graviditet redovisas på två sätt:
- För alla randomiserade kvinnor efter den första planerade embryoåterföringen (ITT-analys).
- För alla kvinnor med en genomförd embryoåterföring.
Andelen graviditeter efter den första planerade embryoåterföringen redovisas i alla sju studierna och i en metaanalys visades inte någon statistiskt signifikant skillnad i graviditetsfrekvens mellan grupperna (Tabell 5.5 och Appendix 6). Vår bedömning är att efter den första planerade embryoåterföringen är effekten av IVF med eller utan PGT‑A jämförbar vad gäller andelen graviditeter (Tabell 5.5).
Då andelen graviditeter för de med en genomförd embryoåterföring från de sju studierna vägdes samman i en metaanalys ändras resultatet från en icke statistiskt signifikant skillnad till en statistiskt signifikant skillnad beroende på om resultatet redovisas som en absolut eller relativ skillnad (Tabell 5.5 och Appendix 6). Vår bedömning är att det inte går att avgöra om det är en skillnad i andel graviditeter för de med en genomförd embryoåterföring (Tabell 5.5).
5.4.4 Ektopisk graviditet
Andelen ektopiska graviditeter har redovisats i två studier [56] [75], se Appendix 6. Författarna hittade ingen statistiskt signifikant skillnad i andel ektopiska graviditeter i någon av studierna. Eftersom studierna redovisat ektopisk graviditet på olika sätt har ingen sammanvägning av resultatet gjorts och vi gör inte heller någon bedömning av tillförlitligheten.
5.4.5 Tid till förlossning
Den totala behandlingstiden till förlossning har redovisats i två studier [76] [56], (Appendix 6). Författarna hittade ingen statistiskt signifikant skillnad i tid till förlossning i någon av studierna. Eftersom studierna redovisat tid till förlossning på olika sätt har ingen sammanvägning av resultatet gjorts och vi gör inte heller någon bedömning av tillförlitligheten.
5.4.6 Livskvalitet hos kvinnan och partnern
Inga relevanta studier identifierades som redovisar livskvaliteten hos kvinnan eller partnern hos de som genomgår IVF med eller utan PGT‑A.
5.4.7 Sammanfattning för de sekundära utfallen
Andel gravida per randomiserad kvinna efter den första planerade embryoåterföringen förefaller vara jämförbar för de som genomgår en IVF-behandling med eller utan PGT‑A. När enbart kvinnor med en genomförd embryoåterföring inkluderas förefaller IVF-behandling med PGT‑A leda till fler förlossningar med levande barn, men det går inte att bedöma om andelen graviditeter skiljer sig åt. Det går inte heller att bedöma om andelen missfall per klinisk graviditet för de med en genomförd embryoåterföring skiljer sig mellan IVF-behandling med eller utan PGT‑A (Tabell 5.5).
| Utfallsmått | Antal deltagare (Antal studier, Studiedesign) Referens |
Effekt OR och RD (95 % KI) |
Resultat | Tillförlitlighet | Avdrag |
|---|---|---|---|---|---|
| Förlossningar med levande barn för de med en genomförd embryoåterföring | 3 049 (7 RCT) [55, 56, 63-65, 75, 76] |
OR 1,49 (1,13 till 1,96) RD 0,09 (0,03 till 0,15) |
Större andel efter IVF med PGT‑Aän efter IVF utan PGT‑A | Låg |
Risk för bias (-1)a Överensstämmelse (-1)b |
| Missfall per klinisk graviditet | 1 515 (5 RCT) [56, 63, 64, 75, 76] |
OR 1,73 (1,01 till 2,98) RD 0,10 (0,01 till 0,18) |
Går inte att bedöma om det är någon skillnad mellan grupperna | Mycket låg |
Risk för bias (-1)c Precision (-2)d |
| Graviditeter efter den första planerade embryoåterföringen (ITT-analys) | 3 442 (7 RCT) [55, 56, 63-65, 75, 76] |
OR 0,97 (0,81 till 1,17) RD 0,00 (-0,04 till 0,04) |
IVF med och utan PGT‑A har jämförbar effekt | Måttlig |
Risk för bias (-1)a |
| Graviditeter för de med en genomförd embryoåterföring | 3 049 (7 RCT) [55, 56, 63-65, 75, 76] |
OR 1,25 (1,00 till 1,57) RD 0,05 (0,00 till 0,10) |
Går inte att bedöma om det är någon skillnad mellan grupperna | Mycket låg |
Risk för bias (-1)a Precision (-2)e |
| IVF = In vitro-fertilisering; KI = konfidensintervall; OR = Odds ratio; PGT‑A = Preimplantatorisk genetisk testning för aneuploidi; RCT = randomiserad kontrollerad studie ; RD = Risk difference. a Majoritet av studierna har hög eller måttlig risk för bias på grund av olika återföringsdagar [65], knapphändig information om randomiseringen och baslinjevärdena [55], enbart resultat för de som följde protokollet [64], återföring av embryon med okänd kromosomuppsättning i PGT‑A gruppen [64] [76] och oklarhet kring randomisering och blindning samt enbart baslinjedata för de som följde protokollet [75]. b Heterogent resultat mellan studierna. 3 studier med hög eller måttlig risk för bias visar på fördel för IVF med PGT‑A, medan 4 studier visar på jämförbar effekt. c Tre av fem studier med hög eller måttlig risk för bias. Hög risk för bias på grund av enbart resultat för de som följde protokollet [64], oklarhet kring randomiseringen och blindning samt enbart baslinjedata för de som följde protokollet [75] och återföring av embryon med okänd kromosomuppsättning i PGT‑A gruppen [64] [76]. d Få händelser och konfidensintervallet gränsar till icke statistiskt signifikant skillnad mellan grupperna. Resultatet är mycket känsligt för hur analysen görs och ändras till en icke statistiskt signifikant skillnad då samma data grupperas utifrån ålder (Figur 7 i Appendix 6) eller då enstaka studier utesluts i känslighetsanalyser. e Konfidensintervallet gränsar till en icke statistiskt signifikant skillnad mellan grupperna. Resultatet är väldigt osäkert eftersom en statistiskt signifikant skillnad beror på om resultatet redovisas som en absolut eller relativ skillnad. Resultatet påverkas även då enstaka studier utesluts i känslighetsanalyser. |
|||||
5.5 Subgruppsanalys: kvinnor 35 år och äldre
5.5.1 Beskrivning av ingående studier
Fyra studier har redovisat resultat för kvinnor 35 år eller äldre. Två av studierna inkluderade bara äldre kvinnor, i den ena var kvinnorna 38 till 41 år gamla [75] och i den andra var de 36 till 40 år gamla [76]. Två av studierna redovisade resultatet för en äldre subgrupp, 35 till 40 år [63] respektive 35 till 37 år [56].
Nedan redovisar vi resultatet för samtliga utfall relaterade till andel förlossningar med levande barn och missfall per klinisk graviditet. Metaanalyserna finns i Appendix 6. I Appendix 4 redovisas våra bedömningar av risk för bias för utfallen för kvinnor 35 år och äldre.
5.5.2 Sammanvägda resultat för kvinnor 35 år och äldre
5.5.2.1 Förlossningar med levande barn efter den första planerade embryoåterföringen per randomiserad kvinna (ITT-analys)
Tre studier med sammanlagt 979 kvinnor 35 år och äldre har redovisat andelen kvinnor med en förlossning med levande barn efter den första planerade embryoåterföringen [63] [75] [76]. Resultaten från de tre studierna vägdes samman i en metaanalys som inte visade någon statistiskt signifikant skillnad i födelsefrekvens mellan grupperna (OR 1,31; 95 % KI 0,98 till 1,75) (Appendix 6).
Vår bedömning är att det inte går att avgöra om det är någon skillnad i andelen förlossningar med levande barn efter den första planerade embryoåterföringen vid IVF med eller utan PGT‑A för äldre kvinnor. Detta eftersom resultatet enbart baseras på tre studier och är mycket osäkert eftersom det ändras från en icke statistiskt signifikant skillnad till en statistiskt signifikant skillnad då enstaka studier utesluts i känslighetsanalyser. Tillförlitligheten till resultatet bedöms vara mycket låg () på grund av risk för bias i de inkluderade studierna samt mycket allvarliga brister i precision för det sammanvägda resultatet (Tabell 5.6).
5.5.2.2 Förlossningar med levande barn för samtliga embryoåterföringar från ett ägguttag, per randomiserad kvinna (ITT-analys)
Tre studier med sammanlagt 733 kvinnor 35 år och äldre har redovisat andelen kvinnor med en förlossning med levande barn för samtliga embryoåterföringar från ett ägguttag [56] [75] [76] . Resultaten från de tre studierna vägdes samman i en metaanalys som inte visade någon statistiskt signifikant skillnad i födelsefrekvens mellan grupperna (OR 0,93; 95 % KI 0,59 till 1,45) (Appendix 6).
Vår bedömning är att efter samtliga embryoåterföringar från ett ägguttag är effekten av IVF med eller utan PGT‑A jämförbar vad gäller andelen förlossningar med levande barn för äldre kvinnor. Tillförlitligheten till resultatet bedöms dock vara låg () på grund av risk för bias i de inkluderade studierna samt brister i precisionen i det sammanvägda resultatet (Tabell 5.6).
5.5.2.3 Sammantaget mått på andel förlossningar med levande barn för de som genomgår en IVF-behandling, per randomiserad kvinna (ITT-analys)
Fyra studier med sammanlagt 1 038 kvinnor 35 år och äldre har redovisat andelen kvinnor med en förlossning med levande barn efter samtliga embryoåterföringar från ett ägguttag eller efter den första planerade embryoåterföringen [56] [63] [75] [76] . Resultaten från de fyra studierna vägdes samman i en metaanalys som inte visade någon statistiskt signifikant skillnad i födelsefrekvens mellan grupperna (OR 1,04; 95 % KI 0,76 till 1,43) (Appendix 6).
Vår bedömning är att för dem som genomgår en IVF-behandling är effekten av IVF med eller utan PGT‑A jämförbar vad gäller andelen äldre kvinnor med en förlossning med levande barn. Tillförlitligheten till resultatet bedöms dock vara låg () på grund av risk för bias i de inkluderade studierna samt brister i precisionen i det sammanvägda resultatet (Tabell 5.6).
5.5.2.4 Förlossningar med levande barn för de med en genomförd embryoåterföring
Tre studier har redovisat andelen kvinnor med en förlossning med levande barn för de sammanlagt 750 kvinnor 35 år och äldre med en genomförd embryoåterföring [63] [75] [76]. Resultaten från de tre studierna vägdes samman i en metaanalys som visade på en statistiskt signifikant skillnad i födelsefrekvens till fördel för PGT‑A gruppen (OR 1,98; 95 % KI 1,24 till 3,17) (Figur 5.4). Det var 15 procentenheter fler förlossningar med levande barn för de med en genomförd embryoåterföring i PGT‑A gruppen (Tabell 5.6) (Appendix 6).
Vår bedömning är att fler äldre kvinnor med en genomförd embryoåterföring efter IVF med PGT‑A får en förlossning med levande barn än efter IVF utan PGT‑A. Tillförlitligheten till resultatet bedöms dock vara låg () på grund av risk för bias i de inkluderade studierna samt brister i precisionen i det sammanvägda resultatet (Tabell 5.6).
5.5.2.5 Missfall per klinisk graviditet
Tre studier har redovisat andelen missfall för de sammanlagt 332 kvinnor 35 år och äldre med en klinisk graviditet efter den första embryoåterföringen [63] [75] [76]. Resultaten från de tre studierna vägdes samman i en metaanalys som inte visade någon statistiskt signifikant skillnad i missfallsfrekvens mellan grupperna (OR 2,87; 95 % KI 0,95 till 8,65) (Appendix 6). Det var dock 18 procentenheter färre missfall för de med en genomförd embryoåterföring i PGT‑A gruppen (Tabell 5.6 och Appendix 6).
Vår bedömning är att det inte går att avgöra om det är en skillnad i andel missfall per klinisk graviditet för de med en genomförd embryoåterföring. Detta eftersom resultatet är osäkert då det ändras från en icke statistiskt signifikant skillnad till en statistiskt signifikant skillnad beroende på om resultatet redovisas som en absolut eller relativ skillnad. Resultatet baseras också på få studier, deltagare och händelser. Tillförlitligheten till resultatet bedöms därför vara mycket låg () på grund av risk för bias i de inkluderade studierna samt mycket allvarliga brister i precision för det sammanvägda resultatet (Tabell 5.6).
5.5.3 Sammanfattning för subgruppen kvinnor 35 år och äldre
För kvinnor 35 år och äldre förefaller andelen förlossningar med levande barn per randomiserad kvinna efter samtliga embryoåterföringar från ett ägguttag, samt det sammantagna måttet på andel förlossningar med levande barn för de som genomgår en IVF-behandling vara jämförbart vid IVF med eller utan PGT‑A, i likhet med resultatet för hela populationen. Även för de kvinnor 35 år och äldre med en genomförd embryoåterföring överensstämmer resultatet med det för hela populationen som visade på fler förlossningar med levande barn för de som fått IVF med PGT‑A jämfört med IVF utan PGT‑A. Det går dock inte att bedöma om andelen förlossningar med levande barn per randomiserad kvinna efter den första planerade embryoåterföringen och missfall per klinisk graviditet efter en embryoåterföring skiljer sig för de kvinnor 35 år och äldre som gjort IVF med eller utan PGT‑A (Tabell 5.6).
| Utfallsmått | Antal deltagare (Antal studier, Studiedesign) Referens |
Effekt OR och RD (95 %KI) |
Resultat | Tillförlitlighet | Avdrag |
|---|---|---|---|---|---|
| Förlossningar med levande barn efter den första planerade embryoåterföringen (ITT-analys) | 979 (3 RCT) [63, 75, 76] |
OR 1,31 (0,98 till 1,75) RD 0,05 (0,00 till 0,10) |
Går inte att bedöma om det är någon skillnad mellan grupperna | Mycket låg |
Risk för bias (-1)a Precision (-2)b |
| Förlossningar med levande barn efter samtliga embryoåterföringar från ett ägguttag (ITT-analys) | 733 (3 RCT) [56, 75, 76] |
OR 0,93 (0,59 till 1,45) RD -0,02 (-0,10 till 0,07) |
IVF med och utan PGT‑A har jämförbar effekt | Låg |
Risk för bias (-1)c Precision (-1)d |
| Sammantaget mått på andel förlossningar med levande barn för de som genomgår en IVF-behandling (ITT-analys) | 1038 (4 RCT) [56, 63, 75, 76] |
OR 1,04 (0,76 till 1,43) RD -0,01 (-0,06 till 0,07) |
IVF med och utan PGT‑A har jämförbar effekt | Låg |
Risk för bias (-1)e Precision (-1)d |
| Förlossningar med levande barn för de med en genomförd embryoåterföring | 750 (3 RCT) [63, 75, 76] |
OR 1,98 (1,24 till 3,17) RD 0,15 (0,04 till 0,27) |
Större andel efter IVF med PGT‑A än efter IVF utan PGT‑A | Låg |
Risk för bias (-1)a Precision (-1)d |
| Missfall per klinisk graviditet efter den första embryoåterföringen | 332 (3 RCT) [63, 75, 76] |
OR 2,87 (0,95 till 8,65) RD 0,18 (0,01 till 0,35) |
Går inte att bedöma om det är någon skillnad mellan grupperna | Mycket låg |
Risk för bias (-1)a Precision (-2)f |
| ITT-analys =Intention to treat-analys; IVF = In vitro-fertilisering; KI = konfidensintervall; OR = Odds ratio; PGT‑A = Preimplantatorisk genetisk testning för aneuploidi; RCT = randomiserad kontrollerad studie; RD = Risk difference. a Tre studier med måttlig risk för bias på grund av avsaknad av baslinjedata för den äldre subgruppen [63], oklarhet kring randomisering och blindning samt enbart baslinjedata för de som följde protokollet [75] och återföring av embryon med okänd kromosomuppsättning i PGT‑A gruppen [76]. b Få studier och deltagare och brett konfidensintervall som gränsar till statistiskt signifikant skillnad mellan grupperna. Resultatet ändras till en statistiskt signifikant skillnad då enstaka studier utesluts i känslighetsanalyser. c Två studier med hög och en med måttlig risk för bias på grund av kort uppföljningstid [75], bristande randomisering och avsaknad av baslinjedata för den äldre subgruppen [56] och återföring av embryon med okänd kromosomuppsättning i PGT‑A gruppen [76]. d Få studier och deltagare och ett brett konfidensintervall. e Två studier med hög och två med måttlig risk för bias på grund av kort uppföljningstid [75], bristande randomisering [56] avsaknad av baslinjedata för den äldre subgruppen [63] [56] och återföring av embryon med okänd kromosomuppsättning i PGT‑A gruppen [76]. f Konfidensintervallet gränsar till en statistiskt signifikant skillnad mellan grupperna. Resultatet är väldigt osäkert eftersom en statistiskt signifikant skillnad beror på om resultatet redovisas som en absolut eller relativ skillnad. Resultatet baseras också på få studier, deltagare och händelser. |
|||||
6. Resultat: Komplikationer av PGT vid IVF
I detta kapitel redovisar vi komplikationer för barnet och mamman. Det som skulle kunna orsaka komplikationer vid PGT-A är biopsin på embryot. Eftersom denna biopsi görs på samma sätt oavsett form av PGT har vi här inkluderat alla varianter av PGT till skillnad från i resultatkapitlet där enbart PGT-A ingår. Vi har gjort en sammanvägning av resultaten för att ge en överblick, men ingen bedömning av tillförlitligheten har gjorts.
6.1 Sammanfattning av resultaten
Totalt identifierades 57 studier med godtagbar risk för bias som redovisar perinatala komplikationer, komplikationer relaterade till moderkakan för kvinnan och långtidsutfall för barnen efter IVF-behandling med eller utan PGT med biopsi. Det finns inget som tyder på några skillnader i komplikationer mellan grupperna.
6.2 Beskrivning av ingående studier
Totalt 57 studier har jämfört komplikationer efter IVF med eller utan PGT med biopsi (Appendix 5). Studierna inkluderar totalt 331 228 deltagare. Det var sju RCT-studier [56, 63, 64, 87-90], tio prospektiva icke-randomiserade studier [17, 91-94] och 40 retrospektiva studier.
De patienter som gör IVF med PGT-A kan antas ha fertilitetsproblem, vilket kan ha en viss koppling till olika typer av komplikationer. I många studier angavs inte vilka varianter av PGT som ingick. För ungefär hälften av studierna inkluderades alla former av PGT [17, 60, 91, 93-112], i 16 studier ingick enbart PGT-A [56, 58, 59, 63, 64, 87, 89, 113-121] och i sju studier enbart PGT-M och/eller PGT-SR [112, 122-127]. I de flesta studierna inkluderades inte IVF-behandlingar med donerade ägg [56, 60, 63, 64, 88-90, 96-98, 103, 108, 109, 111-114, 116-118, 121, 125, 127-133, 135, 137], i många studier är detta inte redovisat och enbart i sex studier framkom det att den typen av behandlingar ingick [87, 95, 106, 107, 115, 119].
Komplikationsrisken skulle kunna påverkas av om biopsin görs tidigt eller sent i embryoutveckling då andelen och typen av celler som tas ut skiljer sig åt. I majoriteten av studierna gjordes biopsin sent i embryoutveckling, det vill säga på blastocyststadiet [56, 58, 59, 63, 64, 95-97, 100-103, 107, 108, 111-114, 116, 117, 119-121, 127, 128, 130, 132, 133, 135, 137], men i 17 studier gjordes den tidigare, runt dag 3 (då embryot har cirka 8 celler) [17, 87-89, 91-94, 98, 104, 105, 110, 122-124, 126]. I fyra studier ingick biopsi vid olika stadium [60] [125] [129] [136] och i två av dessa ingick även biopsi av polkropparna från det befruktade ägget [129] [136]. Om embryona varit frysta kan också påverka uppkomsten av vissa komplikationer (Appendix 8). Sex studier inkluderade bara färska embryon [88, 95, 109, 121, 122, 126]. Tjugotvå studier inkluderade endast frysta embryon [56, 59, 63, 64, 96, 97, 99-103, 108, 111, 112, 116, 120, 127, 130, 132, 133] och övriga studier inkluderade både och [58, 60, 87, 95, 107, 113-115, 117, 123-125, 129, 131, 135] eller saknade information om detta [17, 89, 91-94, 104-106, 110, 119]. Antalet dagar som embryona odlas innan de återförs till kvinnan kan också vara av vikt för uppkomsten av vissa komplikationer (Appendix 8). I majoriteten av studierna återfördes embryona dag 5 eller 6 efter befruktningen [17, 59, 64, 88, 92-94, 96, 97, 99-103, 107, 108, 110-113, 116, 117, 122, 123, 126, 128, 132, 133, 135 ,137], i många var det inte angivet, två studier hade bara tidig återföring (runt dag 3) [87] [124] och i nio studier ingick både återföring dag 3 och senare [63, 89, 90, 98, 114, 115, 125, 131, 136].
6.2.1 Ingående studiers risk för bias
Risken för bias har bedömts för varje enskilt utfall i studierna. I 20 studier bedömdes olika utfall ha olika risk för bias [17, 87, 91, 92, 95, 98, 105-108, 111, 114, 116-118, 124, 125, 129, 130, 135]. I 16 av dessa studier bedömdes vissa utfall få en oacceptabelt hög risk för bias och dessa utfall inkluderades inte [17, 87, 91, 92, 95, 98, 105-108, 114, 116-118, 124, 129]. I de allra flesta fall berodde detta på att utfallen inte hade särredovisats för barn födda i enkelbörd, vilket bedömts vara en förutsättning för en godtagbar risk för bias eftersom tvillingfödslar har stor påverkan på komplikationer. I sju studier bedömdes risken för bias vara måttlig eller hög för de inkluderade utfallen [87, 111, 114, 125, 129, 130, 135]. I två studier bedömdes alla inkluderade utfall ha låg risk för bias [56, 63], i 32 studier måttlig risk för bias [58-60, 64, 88, 90, 95-97, 99, 101-104, 108-110, 112, 113, 115-117, 120-122, 124, 127, 128, 131-133, 138] och i 16 studier hög risk för bias [17, 89, 91-94, 98, 101, 105-107, 118, 119, 123, 126, 136]. I Appendix 4 finns en mer utförlig beskrivning av skälen till bedömningarna.
I Appendix 7 redovisas alla perinatala komplikationer samt komplikationer relaterade till moderkakan, som bedömts ha en godtagbar risk för bias, för respektive studie. I tabellerna framgår också vilka studier som redovisar åtminstone delvis samma population.
6.3 Sammanvägda resultat
För perinatala komplikationer och komplikationer relaterade till moderkakan hos kvinnan har resultaten från studierna sammanställts i en syntes utan metaanalys med rösträkning baserad på effektens riktning (”vote counting based on direction of effect”) [57]. Detta görs för att ge en överblick av vad resultaten i studierna visar. Vi gör dock ingen bedömning av resultatets tillförlitlighet eftersom studierna skiljer sig mycket åt gällande studiedesign, patientpopulationernas karakteristika, hur IVF- och PGT-behandlingarna lagts upp och hur data redovisas (justerade eller ojusterade data). Långtidsutfall hos barnen har enbart redovisats per studie utan sammanvägning eftersom det fanns för få studier med liknande utfallsmått och åldrar på barnen.
6.3.1 Perinatala komplikationer
Vi redovisar resultaten för låg födelsevikt, för tidig födsel, missbildningar, perinatal död och monozygota tvillingar. Missbildningar vid ultraljud redovisas separat från missbildningar vid födseln eftersom frekvensen missbildningar som upptäcks under graviditet är lägre än vid födseln.
I Tabell 6.1 framgår hur stor andel av studierna där effektens riktning lutade åt en högre andel patienter med utfallet i PGT-gruppen (som gjort IVF med biopsi inför PGT) jämfört med kontrollgruppen. Det var inga statistiskt signifikanta skillnader mellan grupperna för de perinatala komplikationerna. I Appendix 7 redovisas alla resultat för respektive studie.
| Totalt antal studier | Totalt antal studier med en riktning på effekten | Studier med högst andel i PGT gruppen | Studier med högst andel i kontrollgruppen | Procent studier med högst andel i PGT gruppen | p-värde för skillnad i andel studier mellan grupperna* | |
|---|---|---|---|---|---|---|
| Låg födelsevikt (<2500g) | 21 | 21 | 8 | 13 | 38 % | 0,38 |
| För tidig födsel (<37 veckor) | 23 | 22 | 9 | 13 | 41 % | 0,52 |
| Perinatal död | 9 | 7 | 3 | 4 | 43 % | 1,00 |
| Missbildningar vid födseln | 22 | 18 | 10 | 8 | 56 % | 0,81 |
| Missbildningar på ultraljud | 4 | 4 | 0 | 4 | 0 % | 0,13 |
| Monozygota tvillingar | 5 | 5 | 3 | 2 | 60 % | 1,00 |
| * p-värdet baseras på ett tvåsidigt binomiellt fördelningstest. |
||||||
6.3.2 Komplikationer relaterade till moderkakan hos kvinnan
Av de åtta komplikationer relaterade till moderkakan hos kvinnan som vi inkluderat i översikten var det sex utfall som rapporterades i minst tre studier och som vi redovisar resultat för. Dessa är graviditetshypertoni, preeklampsi, placenta previa, placentaavlossning, placenta accreta och postpartumblödning. En studie redovisade resultat för eklampsi och ingen studie för placenta percreta.
I Tabell 6.2 framgår hur stor andel av studierna där effektens riktning lutar åt en högre andel patienter med utfallet i PGT-gruppen (som gjort IVF med biopsi inför PGT) jämfört med kontrollgruppen. Det var inga statiskt signifikanta skillnader i andel studier mellan grupperna för komplikationerna relaterade till moderkakan. I Appendix 7 redovisas alla resultat för respektive studie.
| * p-värdet baseras på ett tvåsidigt binomiellt fördelningstest |
||||||
| Totalt antal studier | Totalt antal studier med en riktning på effekten | Studier med högst andel i PGT gruppen | Studier med högst andel i kontrollgruppen | Procent studier med högst andel i PGT gruppen | p-värde för skillnad i andel studier mellan grupperna* | |
|---|---|---|---|---|---|---|
| Graviditets-hypertoni | 18 | 18 | 7 | 11 | 39 % | 0,48 |
| Preeklampsi | 13 | 12 | 6 | 6 | 50 % | 1,00 |
| Placenta previa | 14 | 14 | 8 | 6 | 57 % | 0,79 |
| Placentaavlossning | 11 | 9 | 7 | 2 | 78 % | 0,18 |
| Placenta accreta | 7 | 6 | 3 | 3 | 50 % | 1,00 |
| Postpartum-blödning | 6 | 6 | 5 | 1 | 83 % | 0,22 |
6.3.3 Resultat för långtidsutfall hos barnen
Tio studier har redovisat utfall för barn efter den perinatala perioden [58, 60, 87, 91, 93, 94, 104, 105, 122, 125]. Åldrarna på barnen varierar från 4 månader till 6 år. Sex av studierna inkluderar i stort sett samma grupp barn som följts upp vid olika tidpunkter [91, 93, 94, 104, 105, 122]. Ingen av studierna drar slutsatsen att det finns några skillnader i långtidsutfall för barn som tillkommit genom IVF med PGT jämfört med barn som tillkommit med IVF utan PGT. I Appendix 7 redovisas slutsatserna i respektive studie för långtidsutfallen hos barnen.
7. Hälsoekonomiska aspekter
Samhällets ekonomiska resurser är begränsade och hur de ska fördelas kräver prioriteringar. I en hälsoekonomisk utvärdering analyseras olika interventioners kostnadseffektivitet på ett systematiskt sätt genom att identifiera, kvantifiera och värdera kostnader och effekter för de interventioner man önskar jämföra. Syftet med den hälsoekonomiska analysen är att vara en del av det beslutsunderlag som används av beslutsfattare vid prioriteringar. Kostnadseffektivitet är en av tre principer i den etiska plattformen som enligt riksdagsbeslut ska styra prioriteringar inom hälso- och sjukvården. Mer information om hälsoekonomiska utvärderingar och begrepp som används i detta avsnitt beskrivs i SBU:s metodbok [138].
I detta kapitel redovisas resultaten av den systematiska översikten av den hälsoekonomiska litteraturen och resultaten av de hälsoekonomiska modellanalyserna. De senare baserades på data från den systematiska översikten av effekter, svenska registerdata för IVF-behandling och svenska kostnadsdata (Avsnitt 3.3.2).
7.1 Sammanfattning av resultaten
- I den systematiska översikten av hälsoekonomisk litteratur identifierades två studier med låg till medelhög kvalitet. Studierna täckte olika delar av patientpopulationen; kvinnor mellan 20 och 37 år respektive kvinnor över 37 år. Den första studien baserades på en klinisk studie från Kina, medan den andra utgick från amerikanska registerdata. Dessa länders finansieringssystem och behandlingspraxis vid IVF skiljer sig från Sverige, och resultaten kan förväntas ha en låg överförbarhet till ett svenskt sammanhang om PGT‑A skulle göras tillgängligt i Sverige.
- En stor andel (10 av 12) av relevanta studier uteslöts på grund av låg kvalitet i analys och rapportering. Ofta förekom brister i ingående effektdata, modellanalyser och skattning av osäkerhet.
- Den hälsoekonomiska modellanalysen som vi genomfört utifrån ett svenskt perspektiv och med utgångspunkt i resultaten av den systematiska översikten av effekter visar på ökade kostnader med tillägg av PGT‑A, utan att andelen förlossningar med levande barn ökar. Den extra kostnaden med tillägg av PGT‑A skattas till 37 500 kronor per kvinna och ägguttag, utan någon skillnad i andelen förlossningar med levande barn. Den ökade kostnaden är densamma för kvinnor 35 år och äldre. Känslighetsanalyserna visar att variationer i effekten av PGT‑A påverkar kostnadseffektiviteten.
7.2 Resultat av översikten av hälsoekonomisk litteratur
Totalt identifierades 1 211 publikationer i sökningen efter hälsoekonomiska studier för PGT‑A vid IVF, varav 33 bedömdes vara relevanta för projektets frågeställningar och lästes i fulltext. Av dessa bedömdes 12 studier uppfylla projektets inklusions- och exklusionskriterier. Tio av dessa studier bedömdes ha låg kvalitet gällande hälsoekonomisk metod och uteslöts från rapporteringen (Appendix 2). Generellt gällde bristerna analys och rapportering. De specifika metodproblemen kunde variera mellan studierna; anledningar som förekom bland de flesta studierna omfattar följande:
- bristande transparens av modell, antagande och/eller analyser;
- oklarheter kring härledning av data på behandlingseffekter/olämpliga data på behandlingseffekter;
- olämpliga statistiska metoder för modellanalyser;
- otydliga eller otillräckliga känslighetsanalyser;
- oklart/tveksamt om studiens slutsatser är berättigade utifrån presenterade resultat.
I flera fall noterades även följande problem:
- felaktig modellstruktur som inte speglar det kliniska beslutsfattandet;
- inte alla relevanta effekter inkluderade i modellen (missfall);
- felaktig användning och tolkning av hälsoekonomiska begrepp;
- risk för intressekonflikter.
Två studier bedömdes ha tillräcklig kvalitet för att inkluderas i rapporten jämfört med de studier som uteslöts. De inkluderade studierna baserades på olika delar av patientpopulationen: kvinnor mellan 20 och 37 år samt kvinnor över 37 år. Dessa presenteras i följande avsnitt.
7.2.1 Ekonomisk utvärdering av IVF med PGT-A jämfört med sedvanlig IVF hos kvinnor mellan 20 och 37 år
He och kollegor genomförde en ekonomisk utvärdering av IVF med PGT-A jämfört med endast IVF i Kina [139]. Utvärderingen gjordes utifrån en klinisk studie som inkluderats i Kapitel 5 [56]. I studien ingick kvinnor mellan 20 och 37 år vars egna ägg kunde användas. I den ekonomiska analysen kunde patienterna i PGT‑A gruppen totalt få mellan 0 och 3 embryon överförda, medan alla patienter i sedvanliga IVF-gruppen totalt antogs erhålla 3 embryon.
Kostnaderna inkluderade IVF-behandlingen, undersökningar, läkemedel, samt åtgärder vid förlossning och missfall. Medelkostnaden per patient var 2 785 Chinese Yuan Renminbi (CNY) högre i gruppen som genomgick PGT‑A, vilket motsvarar cirka 3 700 SEK5 i 2021 års priser. Den kumulativa andelen förlossningar med levande barn per ägguttag (som innehöll upp till tre återföringsförsök) var 0,84 i PGT‑A gruppen jämfört med 0,90 i sedvanliga IVF-gruppen. Detta beror på den ekonomiska analysens upplägg som antog att IVF-gruppen alltid genomgick tre återföringsförsök (även om så inte var fallet i den kliniska studien). Därmed bedömdes IVF utan PGT‑A som mer effektivt avseende kumulativa andelen levande födda barn och förknippat med lägre kostnader än IVF med PGT‑A för det antagna behandlingsupplägget.
Känslighetsanalyserna och deras resultat är otydligt presenterade och stödjer inte nödvändigtvis författarnas bedömning om robusta resultat. Detta gäller även författarnas analyser av tröskelvärden för att PGT‑A kan anses vara kostnadseffektivt. Analyserna är inte meningsfulla utan referens till någon form av etablerade tröskelvärden för viljan att betala för en ökning i sannolikheten att föda ett levande barn. Sammantaget bedömdes studiens kvalitet avseende hälsoekonomisk metod som låg till medelhög jämfört med uteslutna hälsoekonomiska studier.
5. Omräknat från CNY år 2021 till SEK år 2021 med valutauppgift från Riksbanken: https://www.riksbank.se/sv/statistik/rantor-och-valutakurser/sok-rantor-och-valutakurser/?s=g130-SEKCNYPMI&a=Y&from=2021-01-04&to=2021-12-30&fs=3#result-section
7.2.2 Ekonomisk utvärdering av IVF med PGT‑A jämfört med sedvanlig IVF hos kvinnor över 37 år
Collins och kollegor genomförde en ekonomisk utvärdering av IVF med PGTA‑ jämfört med IVF utan PGT‑A i ett amerikanskt sammanhang för kvinnor som var över 37 år [140]. De flesta antaganden om kliniska effekter baserades på en observationsstudie av nästan alla IVF-kliniker i USA [141]. Den ekonomiska utvärderingen fokuserade på kvinnor som utvecklat åtminstone en blastocyst, och analyserade kostnader och effekter av en embryoåterföring med färska embryon. IVF-gruppen kunde få en insättning av upp till två embryon.
Kostnaderna inkluderade PGT‑A, embryoåterföring, hantering av missfall, fostervattenprov, genetisk rådgivning och abort under andra graviditetstrimestern (vid avvikande fostervattenprov); kostnader för förlossningen ingick inte. Medelkostnaden per patient var 4 509 USD högre i gruppen som genomgick PGT‑A, vilket motsvarar cirka 38 600 SEK6 i 2016 års priser. Andelen förlossningar med levande barn (vid en embryoåterföring) var 24,9 % vid IVF med PGT‑A jämfört med 20,7 % för sedvanlig IVF. Kostnaden för att uppnå en ytterligare förlossning med levande barn var därmed 105 489 USD (motsvarande omkring 903 100 SEK6).
Resultaten var känsliga för ändringar i antaganden kring kostnader och effekter. Utifrån data från litteraturen räknade författarna fram en kostnadseffektivitetskvot för sedvanlig IVF och använde detta som tröskelvärde för att bedöma om PGT‑A är kostnadseffektivt eller inte. Dels förutsätter det att ingående data är relevanta och tillförlitliga, dels att det finns en logisk grund för det härledda tröskelvärdet; dessa förutsättningar saknas i artikeln. Sammantaget bedömdes studiens kvalitet avseende hälsoekonomisk metod som låg till medelhög jämfört med uteslutna hälsoekonomiska studier.
6. Omräknat från USD år 2016 till SEK år 2016 med valutauppgift från Riksbanken https://www.riksbank.se/sv/statistik/rantor-och-valutakurser/sok-rantor-och-valutakurser/?s=g130-SEKUSDPMI&a=Y&from=2016-01-04&to=2016-12-30&fs=3#result-section
7.3 Skattningar från modellanalys
Skattningarna från modellanalysen utgår från resultaten av metaanalyserna. För det primära utfallet visade effektanalyserna att andelen förlossningar med levande barn är jämförbar för de som genomgår en IVF-behandling med eller utan PGT‑A, både vid den första planerade embryoåterföringen och då samtliga embryoåterföringar från ett ägguttag utvärderades (Avsnitt 5.3). För det sekundära utfallet andelen graviditeter bedömdes effekten av IVF med eller utan PGT‑A också vara jämförbar vid den första planerade embryoåterföringen (Avsnitt 5.4). Dessa utfall bedömdes ha låg respektive måttlig tillförlitlighet. Dessutom har man i översikten av komplikationer inte funnit några tydliga skillnader vad gäller perinatala komplikationer, komplikationer relaterade till moderkakan för kvinnan och långtidsutfall för barnen efter IVF-behandling med eller utan PGT med biopsi (Kapitel 6). Detta stödjer antagandet vi gjorde om att inte inkludera komplikationer i modellen.
7.3.1 Resultat grundscenario
Resultaten för genomsnittliga kostnader och effekter per jämförelsegrupp för kvinnor i alla åldrar respektive kvinnor 35 år och äldre presenteras i Tabell 7.1. Dessutom visas skillnaden mellan IVF med och utan PGT‑A, samt resulterande kostnadseffektivitet. Kostnaderna och effekterna representerar det förväntade genomsnittet för en kvinna som ska genomgå IVF med respektive utan PGT‑A, viktat med sannolikheterna för de olika händelserna (återföring eller inte, graviditet eller inte, förlossning med levande barn eller missfall). Händelserna är förknippade med olika kostnader; se Avsnitt 3.3.2 för modellen samt ingående sannolikheter och kostnader.
Eftersom effekten av IVF med tillägg av PGT‑A i grundscenariot är densamma som för IVF utan PGT‑A, blir grundscenariot en kostnadsjämförelse som visar på ökade kostnader utan förändring av andelen levande födda barn. Den ökade kostnaden med tillägg av PGT‑A är 37 500 kronor per kvinna, utan någon förändring i andelen förlossningar med levande barn. Den ökade kostnaden är densamma för kvinnor 35 år och äldre. I den gruppen är sannolikheterna att bli gravid och föda ett levande barn lägre vid IVF, vilket leder till lägre genomsnittskostnader och färre förlossningar med levande barn; skillnaden i kostnader mellan behandlingsgrupperna förblir dock oförändrad.
| PGT‑A + IVF | IVF | Inkrementell skillnad | Kostnadseffektivitet (ICER) | |
|---|---|---|---|---|
| Alla åldrar | ||||
| Kostnader (SEK)a | 116 265 | 78 765 | 37 500 | PGT‑A leder inte till fler levande barn och medför ökade kostnader |
| Förlossningar med levande barna | 0,420 | 0,420 | 0,000 | |
| Kvinnor 35 år och äldre | ||||
| Kostnader (SEK)a | 110 510 | 73 010 | 37 500 | PGT‑A leder inte till fler levande barn och medför ökade kostnader |
| Förlossningar med levande barna | 0,345 | 0,345 | 0,000 | |
| a Kostnader och förlossningar med levande barn representerar förväntade genomsnitt per kvinna som ska genomgå IVF med respektive utan PGT‑A. ICER = inkrementell kostnadseffektivitetskvot, i detta fall kostnad per förlossning med levande barn; IVF = In vitro-fertilisering; PGT‑A = Preimplantatorisk genetisk testning för aneuploidi; SEK = svenska kronor. |
||||
7.3.2 Resultat känslighetsanalyser
Följande figur visar känslighetsanalyser kring kostnader och hur de påverkar kostnadsskillnaden mellan IVF med och utan PGT‑A (effektskillnaden förblir oförändrad) (Figur 7.1). Kostnadsskillnaderna varierar mellan omkring 30 000 och 45 000 kronor då kostnader på minus eller plus 20 procent antas.
Tabell 7.2 visar resultaten av olika känslighetsanalyser kring effekten av PGT‑A på graviditeter och förlossningar med levande barn, för hela patientgruppen. I tabellen visas både skillnaden i kostnader och på antalet förlossningar med levande barn mellan grupperna. Utifrån konfidensintervallet för det primära utfallsmåttet varierades de relativa riskerna för graviditeter och förlossningar med levande barn (Appendix 10) med 1, 5 och 10 procent i båda riktningarna. Den 10-procentiga variationen i effekt omfattar även det icke-signifikanta medelvärdet för det primära effektmåttet.
Om effekten vore lägre än i grundscenariot (IVF med PGT‑A skulle ha en sämre effekt än enbart IVF), leder användningen av PGT‑A till ökade kostnader och färre förlossningar med levande barn; i dessa fall skulle IVF vara det dominanta alternativet. Om effekten av PGT‑A däremot vore högre än i grundscenariot (IVF med PGT‑A skulle ha en bättre effekt än enbart IVF), skulle användningen av PGT‑A leda till ökade kostnader och fler förlossningar med levande barn. Ökningen i kostnader blir större än vid känslighetsanalysen med lägre effekt, eftersom fler kvinnor blir gravida (vilket för med sig kostnader för barnmorskebesök) och får levande födda barn (vilket för med sig kostnader för förlossning). Den ökade kostnaden sätts sedan i relation till det ökade antalet förlossningar med levande barn. Vid en ökning i effekt med 1 procent skulle den inkrementella kostnadseffektkvoten (ICER) bli omkring 9 miljoner per förlossning med levande barn; vid en ökning med 10 procent skulle den inkrementella kostnadseffektkvoten (ICER) bli omkring 972 000 kronor per förlossning med levande barn.
Skillnaderna i kostnader och förlossningar med levande barn representerar genomsnittsvärden för en kvinna som ska genomgå IVF med PGT‑A. Det betyder exempelvis för en kohort på 100 kvinnor (oavsett ålder) att IVF med PGT‑A i grundscenariot skulle leda till 0 fler förlossningar med levande barn än IVF utan PGT‑A. Vid en 10 procent lägre effekt för PGT‑A skulle det bli 4,2 färre förlossningar med levande barn, medan en 10 procent bättre effekt för PGT‑A skulle leda till 4,2 fler förlossningar med levande barn.
Sammantaget visar resultaten av känslighetsanalyserna på den centrala rollen som effekten av PGT‑A har på kostnadseffektiviteten.
| Variation i relativa risker för graviditeter och förlossningar med levande barn | Skillnad kostnader (SEK) | Skillnad förlossningar med levande barn | Inkrementell kostnadseffektkvot (ICER) |
|---|---|---|---|
| Relativa risker minskar med 10 % | 34 204 | -0,042 | PGT‑A leder till färre levande barn och kostar mer (IVF dominant) |
| Relativa risker minskar med 5 % | 35 852 | -0,021 | PGT‑A leder till färre levande barn och kostar mer (IVF dominant) |
| Relativa risker minskar med 1 % | 37 170 | -0,004 | PGT‑A leder till färre levande barn och kostar mer (IVF dominant) |
| Relativa risker ökar med 1 % | 37 830 | 0,004 | 9 013 380 |
| Relativa risker ökar med 5 % | 39 148 | 0,021 | 1 865 510 |
| Relativa risker ökar med 10 % | 40 796 | 0,042 | 972 026 |
| Not: Resultaten avser skillnader i förväntade genomsnittliga kostnader och förlossningar med levande barn, per kvinna som ska genomgå IVF med respektive utan PGT‑A. ICER = inkrementell kostnadseffektkvot, i detta fall kostnad per förlossning med levande barn; IVF = In vitro-fertilisering; PGT‑A = Preimplantatorisk genetisk testning för aneuploidi; SEK = svenska kronor. |
|||
Tabell 7.3 visar resultaten av olika känslighetsanalyser kring effekten av PGT‑A på graviditeter och förlossningar med levande barn, för kvinnor 35 år och äldre. I tabellen visas både skillnaden i kostnader och antalet förlossningar med levande barn mellan grupperna. Resultaten liknar dem för hela patientpopulationen. För kvinnor 35 år och äldre skulle den inkrementella kostnadseffektkvoten bli omkring 11 miljoner kronor per förlossning med levande barn om de relativa riskerna ökar med 1 procent, och 1,2 miljoner kronor per förlossning med levande barn vid en ökning på 10 procent. För en kohort på 100 kvinnor 35 år och äldre betyder detta att IVF med PGT‑A i grundscenariot skulle leda till 0 fler förlossningar med levande barn än IVF utan PGT‑A. Vid en 10 procent lägre effekt för PGT‑A skulle det bli 3,4 färre förlossningar med levande barn, medan en 10 procent bättre effekt för PGT‑A skulle leda till 3,4 fler förlossningar med levande barn.
| Variation i parametrar | Skillnad kostnader (SEK) | Skillnad förlossningar med levande barn | Inkrementell kostnadseffektkvot (ICER) |
|---|---|---|---|
| Relativa risker minskar med 10 % | 34 779 | -0,034 | PGT‑A leder till färre levande barn och kostar mer (IVF dominant) |
| Relativa risker minskar med 5 % | 36 139 | -0,017 | PGT‑A leder till färre levande barn och kostar mer (IVF dominant) |
| Relativa risker minskar med 1 % | 37 228 | -0,003 | PGT‑A leder till färre levande barn och kostar mer (IVF dominant) |
| Relativa risker ökar med 1 % | 37 772 | 0,003 | 10 954 111 |
| Relativa risker ökar med 5 % | 38 861 | 0,017 | 2 253 951 |
| Relativa risker ökar med 10 % | 40 221 | 0,034 | 1 166 431 |
| Not: Resultaten avser skillnader i förväntade genomsnittliga kostnader och förlossningar med levande barn, per kvinna som ska genomgå IVF med respektive utan PGT‑A. ICER = inkrementell kostnadseffektkvot, i detta fall kostnad per förlossning med levande barn; IVF = In vitro-fertilisering; PGT‑A = Preimplantatorisk genetisk testning för aneuploidi; SEK = svenska kronor. |
|||
8. Etiska aspekter
8.1 Sammanfattning av resultaten
Nedan sammanfattas de viktigaste etiska aspekterna som är förknippade med PGT-A vid IVF i ett svenskt sammanhang.
- För att det ska vara motiverat att erbjuda en medicinsk åtgärd krävs att dess nackdelar vägs upp av en tydlig patientnytta. PGT-A bedöms inte i rådande kunskapsläge uppfylla detta villkor eftersom någon tydlig nytta inte visats.
- Om PGT-A vid IVF ska erbjudas inom offentligt finansierad hälso- och sjukvård krävs ställningstagande om hur högt åtgärden ska prioriteras jämfört med annan vård. Inom både offentlig och privat vård krävs vidare analys av hur eventuella undanträngningseffekter ska hanteras.
- Patienters informerade samtycke till PGT-A vid IVF kan försvåras av att de kan ha orealistiska förväntningar. För att motverka sådana förväntningar krävs att den som informerar patienter är insatt i kunskapsläget på området och ger en korrekt och heltäckande bild av detta.
- Vid en eventuell framtida översyn av regleringen av PGT-A vid IVF kan det finnas behov av att analysera vad det skulle innebära för personer med funktionsnedsättning om åtgärden tillåts och används.
- Vid en sådan översyn kan det också finnas behov av att se över hur andra möjligheter att välja embryon vid IVF, exempelvis utifrån kön och framtida sjukdomsrisk, ska regleras och hanteras av professionen.
8.2 Inledning
PGT-A vid IVF är idag inte tillåtet i Sverige [23]. Detta kapitel fokuserar på etiska aspekter som bör beaktas om åtgärden skulle tillåtas i framtiden. Rapporten tar inte ställning till om åtgärden bör tillåtas ur ett etiskt perspektiv eftersom SBU inte har i uppdrag att göra sådana ställningstaganden. För att det ska vara etiskt försvarbart att erbjuda en medicinsk åtgärd anses det dock normalt som nödvändigt att dess nackdelar vägs upp av en tydlig och påvisad patientnytta. Det räcker inte att åtgärden inte medför någon försämring för patienter eller inte utsätter dem för påtagliga medicinska risker, eftersom alla medicinska åtgärder tar begränsade resurser i anspråk och innebär någon form av börda för patienter. Detta villkor gäller såväl offentligt finansierad som privat vård och är förankrat i hälso- och sjukvårdslagens (2017:30) krav på att vården “ska vara av god kvalitet” (5 kap 1§ 1 stycket) samt i patientsäkerhetslagens (2010:569) krav på att “hälso- och sjukvårdspersonalen ska utföra sitt arbete i överensstämmelse med vetenskap och beprövad erfarenhet” (6 kap 1§). Översiktens resultat visar att IVF med eller utan PGT-A förefaller leda till en jämförbar andel levande födda barn. Vår översikt visar inte heller på någon annan tydlig patientnytta eller att någon särskild patientgrupp har nytta av PGT-A. I ljuset av detta kan PGT-A vid IVF i rådande kunskapsläge inte sägas uppfylla villkoret om att nackdelar vägs upp av en påvisad patientnytta. Denna bedömning kan emellertid ändras om kunskapsläget förändras på ett sådant sätt att en tydlig patientnytta kan påvisas.
Projektgruppen har identifierat ett antal etiska aspekter som bör beaktas om PGT-A vid IVF tillåts i Sverige. Detta har skett genom diskussioner inom gruppen utifrån SBU:s vägledning [70], granskning av utvald vetenskaplig kvalitativ och etisk litteratur, samt samtal med brukarorganisationer (Avsnitt 3.5). De etiska aspekterna kan delas in i fyra olika teman: finansiering och prioriteringar, informerat samtycke, betydelsen av PGT-A vid IVF för personer med funktionsnedsättning samt det sluttande planet.
8.3 Finansiering och prioriteringar
I Sverige erbjuds IVF idag inom både privat och offentligt finansierad hälso- och sjukvård. Om IVF med PGT-A tillåts uppstår frågan om åtgärden ska erbjudas inom offentlig vård. Den skulle i så fall konkurrera om samma begränsade gemensamma resurser som all annan offentligt finansierad vård. Detta kräver ställningstagande om hur högt den ska prioriteras jämfört med andra åtgärder. Prioriteringar i hälso- och sjukvården ska styras utifrån en etisk plattform där större behov av vård ska ges företräde framför mindre behov [142]. Normalt anses storleken på behovet bero på svårighetsgraden av patientens tillstånd. I utredningen som föregick riksdagens beslut om den etiska plattformen bedömdes behovet av åtgärder mot ofrivillig barnlöshet som förhållandevis litet (SOU 1995:5). Samtidigt framhåller såväl brukarorganisationer som WHO att ofrivillig barnlöshet kan ha betydande påverkan på livskvalitet [143]. Barnlöshet har vidare i forskningen kopplats till olika former av sämre hälsa [144].
Utöver svårighetsgrad ska prioriteringar i hälso- och sjukvården ta hänsyn till nyttan för patienten och kostnadseffektivitet [142]. Nyttan fångas av den systematiska översiktens resultat avseende effekt och komplikationer (Kapitel 5 och 6) och kostnadseffektiviteten beskrivs i kapitlet om hälsoekonomiska aspekter (Kapitel 7). Generellt kan sägas att ett stort behov av en åtgärd (i meningen att tillståndet har hög svårighetsgrad) inte är tillräckligt för att åtgärden ska prioriteras framför andra åtgärder. Det krävs också att åtgärden gör nytta och är tillräckligt kostnadseffektiv jämfört med andra åtgärder mot samma tillstånd eller åtgärder mot andra tillstånd med liknande svårighetsgrad.
Om PGT-A vid IVF enbart erbjuds inom privat finansierad vård så konkurrerar den inte om gemensamma resurser på samma sätt eftersom patienten själv står för kostnaden. Istället uppstår frågan om åtgärden riskerar att bidra till ökad ojämlikhet i samhället. Farhågan är att ofrivilligt barnlösa patienter som har det bättre ekonomiskt ställt får en ytterligare fördel framför liknande patienter som har det sämre ställt och därför saknar tillgång till åtgärden [145]. I Sverige råder redan idag ojämlika förutsättningar att få barn med hjälp av IVF. Endast patienter som själva kan betala har tillgång till IVF om de tre kostnadsfria försöken som regionerna erbjuder misslyckas eller om villkoren som ställs inom offentlig vård inte uppfylls (Avsnitt 2.4.1). I ljuset av den systematiska översiktens resultat bedöms denna ojämlikhet inte förvärras av att man dessutom får tillgång till PGT-A, eftersom IVF med eller utan PGT-A förefaller leda till en jämförbar andel levande födda barn (Kapitel 5).
Oavsett hur PGT-A vid IVF finansieras finns en risk att så kallade undanträngningseffekter uppstår vid ett eventuellt införande, eftersom åtgärden kräver embryologisk och genetisk specialkompetens, vilken är en begränsad resurs idag. Om denna kompetens tas i anspråk för PGT-A vid IVF kan andra åtgärder som också kräver embryologisk och genetisk specialkompetens tvingas stå tillbaka inom såväl offentligt som privat finansierad vård. Undanträngningseffekter är inte nödvändigvist etiskt oacceptabla, men för att de ska kunna anses godtagbara krävs att de kan motiveras utifrån den etiska plattformen för prioriteringar [142]. Detta innebär bland annat att de medicinska behov som får stå tillbaka på grund av att PGT-A vid IVF införs inte får vara större än de behov som tillgodoses.
8.4 Informerat samtycke
Ett allmänt etiskt och juridiskt krav är att patienter ger sitt informerade samtycke till åtgärder inom hälso- och sjukvården, oavsett om den bedrivs i privat eller offentlig regi. Detta regleras i Sverige av patientlagen (2014:821, kap 3 och kap 4) och grundar sig i respekt för patientens självbestämmande (autonomi). Ett informerat samtycke förutsätter att patienten ges korrekt och heltäckande information om åtgärden och dess effekter. Informationen ska också vara anpassad till patientens specifika behov och ges på ett sätt som patienten förstår.
Om PGT-A tillåts i Sverige kan patienters informerade samtycke till åtgärden försvåras av att de kan ha orealistiska förväntningar. Enligt internationell forskning förekommer det att patienter tror att PGT-A har en bättre effekt på utfallet av IVF än vad det vetenskapliga underlaget visar [146] [147] [148]. Brukarorganisationer menar att sådana förväntningar även förekommer bland patienter i Sverige. Vidare visar studier att fertilitetskliniker ibland marknadsför PGT-A på sätt som främjar sådana orealistiska förväntningar [149]. För att säkerställa ett informerat samtycke till PGT-A är det därför av stor vikt att den som informerar patienter är insatt i kunskapsläget på området och ger en korrekt och heltäckande bild av detta.
Brukarorganisationer framhåller vidare att patienters starka önskan att få barn är en annan utmaning då informerat samtycke ska säkerställas. Denna önskan sägs kunna påverka patienters förmåga att ta till sig och resonera kring information. Det är viktigt att komma ihåg att patienter även i många andra sammanhang har en stark önskan om att de åtgärder som erbjuds har en gynnsam effekt. Detta anses normalt inte göra patienter oförmögna att samtycka till åtgärder, även om den kanske kan försvåra samtalet som föregår samtycket.
Ytterligare en utmaning när det gäller informerat samtycke är förekomsten av mosaiska embryon, vilka har en blandning av celler med normal och avvikande kromosomuppsättning (Avsnitt 2.3.2). När en patient saknar embryon med normal kromosomuppsättning kan frågan uppstå om ett mosaiskt embryo ska återföras. Internationell forskning visar att patienter upplever att sådana beslut är påfrestande samt framhåller behovet av välanpassad information och psykologiskt stöd [150]. I svensk hälso- och sjukvård betraktas det normalt som en fråga för professionen snarare än patienten vilka åtgärder en patient ska erbjudas. Självbestämmandet innebär i första hand att patienter har rätt att bestämma om den åtgärd som erbjuds ska tas emot. Det ger normalt inte rätt att kräva åtgärder som inte anses medicinskt motiverade eller att välja bland flera alternativa åtgärder. Därför är det professionen som bör bedöma om det är lämpligt att återföra ett mosaiskt embryo. Patienten bör emellertid informeras om skälen till bedömningen. Om återföring erbjuds har patienten vidare rätt till den information som krävs för att ta ställning till erbjudandet. Denna information bör då ges med hänsyn tagen till att ställningstagandet kan upplevas som svårt.
8.5 Betydelsen av PGT-A för personer med funktionsnedsättning
I den internationella debatten om fosterdiagnostik är en återkommande farhåga att abort av foster med genetiska avvikelser kopplade till funktionsnedsättningar uttrycker en negativ attityd till personer som har dessa funktionsnedsättningar. Att med hjälp av fosterdiagnostik undvika att ett barn föds med en kromosomavvikelse jämförs med att säga att det skulle vara bättre att människor som redan lever med denna avvikelse inte fanns [151]. Brukarorganisationer har lyft en liknande farhåga när det gäller PGT-A vid IVF. Det uttryckliga syftet med åtgärden är inte att undvika att barn med kromosomavvikelser föds, utan att öka sannolikheten för en lyckad IVF-behandling. Men för att uppnå detta väljs (i normalfallet) embryon utan kromosomavvikelser framför embryon med sådana avvikelser. Ett sådant val skulle kunna anses spegla en lägre värdering av embryon av det senare slaget. Detta skulle kunna uppfattas som uttryck för en negativ attityd till personer som lever med kromosomavvikelser i samhället.
Det är dock inte uppenbart att denna attityd kan jämföras med den attityd som sägs komma till uttryck vid fosterdiagnostik följt av abort. Valet att avbryta en graviditet med ett foster med en kromosomavvikelse kan tolkas som uttryck för uppfattningen att det är bättre att inte ha något barn alls än ett barn med en sådan avvikelse. I den mån PGT-A vid IVF uttrycker någon uppfattning om det eventuella framtida barnet verkar det istället vara att ett barn utan avvikelse är att föredra framför ett barn med en avvikelse. Dessa båda attityder framstår som olika, även om det inte kan uteslutas att båda kan uppfattas som negativa gentemot personer med funktionsnedsättningar.
Brukarorganisationernas farhåga gäller dock inte främst de attityder som uttrycks av enskilda patienters val utan ett synsätt på samhällsnivå. Det uppfattas som ett problem att samhällsinstitutioner (exempelvis genom lagstiftning och hälso- och sjukvårdspraxis) tillåter och erbjuder åtgärder som förhindrar existensen av människor med funktionsnedsättningar som är förenliga med ett fullgott liv. Detta anses både spegla och understödja en i samhället utbredd negativ inställning till människor med funktionsnedsättningar. Invändningen riktar sig främst mot den breda och rutinmässiga användning av fosterdiagnostik som idag sker i Sverige. Man menar dock att den negativa attityden skulle förstärkas om samhället tillät och erbjöd PGT-A vid IVF. Detta anser man i sin tur skulle kunna inverka negativt på hur människor med funktionsnedsättningar bemöts och behandlas i många olika sammanhang.
Vid en eventuell framtida översyn av regleringen av PGT-A vid IVF kan det finnas behov av att analysera vad det skulle innebära för personer med funktionsnedsättning om åtgärden tillåts och används. I denna process bör dessa grupper själva få komma till tals och det bör undersökas både hur en sådan förändring upplevs och vilka konsekvenser den kan få. PGT-A bör då också sättas in i ett större sammanhang. Vad åtgärden uttrycker och hur den påverkar attityder till personer med funktionsnedsättningar beror sannolikt delvis på hur samhällets aktörer bemöter och behandlar dessa personer i andra sammanhang.
8.6 Det sluttande planet
En återkommande fråga inom projektet har varit om ett tillåtande av PGT-A vid IVF skulle kunna leda till att åtgärden används på etiskt problematiska sätt, bana väg för andra liknande kontroversiella åtgärder eller få andra oönskade långsiktiga konsekvenser. Farhågan är att PGT-A vid IVF skulle bli det första steget på ”ett sluttande plan”. Detta resonemang blir spekulativt eftersom det hänvisar till möjliga men svårbedömda konsekvenser av ett beslut. Eftersom tankar om ett sluttande plan har lyfts vid upprepade tillfällen såväl inom projektgruppen som av brukarorganisationer är en diskussion ändå motiverad.
En konsekvens av att tillåta PGT-A vid IVF skulle vara att det blir möjligt att välja embryon baserat på kön i samband med att åtgärden genomförs [152]. Vid PGT-A framgår det om embryon har manliga (XY) eller kvinnliga (XX) könskromosomer. Eftersom patienter har rätt att få del av resultatet av testet skulle de även ha tillgång till denna information. Frågan uppstår därmed om patienters önskemål om sitt eventuella framtida barns kön ska tillåtas påverka vilka embryon som återförs.
Könsselektion i samband med IVF är idag inte tillåtet i Sverige [23] men förekommer internationellt. I ett europeiskt sammanhang är sådana val kontroversiella [153]. Ett eventuellt framtida tillåtande av PGT-A vid IVF kan därför behöva föregås av en diskussion om hur patienters eventuella önskemål om att välja kön ska hanteras både i lagstiftningen och inom professionen.
En annan tänkbar konsekvens av att tillåta PGT-A vid IVF är att detta banar väg för att andra tekniker som gör det möjligt att välja embryon på genetiska grunder också tillåts. En sådan teknik är PGT-P, som används för att välja ut IVF-embryon utifrån uppskattad framtida risk att drabbas av sjukdomar som beror på flera gener. PGT-P är idag inte tillåtet i Sverige [23] men görs i flera andra länder [34]. Studier från USA visar att det finns ett intresse av åtgärden bland IVF-patienter och ett stöd för den i befolkningen [154] [155]. Samtidigt bedömer många experter att det är för tidigt att använda PGT-P kliniskt, bland annat eftersom uppskattningen av riskerna inte anses tillräckligt tillförlitlig [34] [154] [156]. PGT-P kan i princip även användas för att välja IVF-embryon utifrån uppskattade sannolikheter att utveckla olika önskade egenskaper, såsom önskad kroppslängd eller intelligens [34]. Sådana användningar är särskilt kontroversiella, men uppges ha erbjudits av åtminstone en klinik i USA [155].
Även om det i dagsläget inte bedöms som aktuellt att använda PGT-P i Sverige kan det vid en eventuell framtida översyn av regleringen av PGT-A finnas behov av att även beakta hur sådana val ska regleras. Den vetenskapliga utvecklingen på området går fort och drivs på av såväl kommersiella intressen som av önskemål från patienter om ökade valmöjligheter [154]. Vidare kan en lagändring i syfte att tillåta PGT-A potentiellt påverka även PGT-P eftersom teknikerna regleras av samma lagparagraf.
I ett vidare perspektiv medför utvecklingen på genteknikområdet ökande valmöjligheter vid assisterad befruktning och graviditet, något som på sikt kan tänkas få betydande konsekvenser för individer och samhälle [157]. PGT-A kan betraktas som en del av denna bredare utveckling. Att analysera denna utveckling i sin helhet ligger dock utanför ramarna för detta projekt.
9. Diskussion
9.1 Resultatdiskussion
I den litteratur som identifierats och som ligger till grund för denna systematiska översikt har vi inte funnit något stöd för att IVF med PGT‑A jämfört med IVF utan PGT‑A leder till fler förlossningar med levande barn för kvinnor som randomiserats till PGT‑A. Detta gäller vid ITT-analys av den första planerade embryoåterföringen så väl som samtliga embryoåterföringar från ett ägguttag, liksom när dessa mått analyserats sammantaget för alla kvinnor som genomgår en IVF-behandling, vilket styrker resultatet. Tillförlitligheten till resultaten bedöms vara låg eftersom de inkluderade studierna är relativt få och i vissa fall har betydande brister. Detta ska dock inte tolkas som att resultaten är mycket osäkra och inte går att bedöma, utan istället att det finns en viss osäkerhet i resultaten och att fler studier behövs för att fastställa robustheten i resultaten. För utfallen missfall per klinisk graviditet och den totala behandlingstiden till förlossning är resultatet alltför osäkert eller begränsat till enstaka studier, vilket gör att det inte går att dra några slutsatser. Inte heller vad gäller komplikationer drar vi några slutsatser eftersom ingen bedömning av tillförlitligheten gjorts, men de sammanvägda resultaten tyder inte på några skillnader i komplikationer för barnet eller den gravida kvinnan efter PGT med biopsi av embryot. En central etisk aspekt som identifierats är att när en medicinsk åtgärd erbjuds krävs en tydligt påvisad patientnytta som väger upp dess nackdelar, såsom risker och bördor för patienterna, kostnader, samt användning av begränsade resurser. Eftersom vår systematiska översikt inte visar på någon tydlig patientnytta samtidigt som PGT‑A nästan fördubblar kostnaden för en IVF-behandling bedöms PGT‑A i dagsläget inte uppfylla detta villkor.
Effekten av IVF med PGT‑A på andel förlossningar med levande barn
Våra primära utfallsmått var förlossning med levande barn per randomiserad kvinna efter första planerade embryoåterföringen samt kumulativt efter samtliga möjliga embryoåterföringar från ett ägguttag. Vi inkluderade även ett mått som sammanfattade bägge de primära utfallen, i första hand för att få en totalbild av resultaten med samtliga studier inkluderade. Det kumulativa antalet förlossningar med levande barn från ett ägguttag ger en helhetsbild av förlossningsresultaten och anses av många vara det mest betydelsefulla utfallet efter IVF [18] [158]. Det har hävdats att PGT‑A, teoretiskt sett, inte skulle kunna öka det kumulativa antalet förlossningar med levande barn från ett ägguttag, vilket går i linje med våra resultat. Orsaken är att man hos kvinnor utan PGT‑A så småningom ändå återför embryot som leder till graviditet och förlossning. PGT‑A är ju enbart en metod för att välja ut vilka embryon som ska återföras, och om flera finns att välja mellan, i vilken ordning de återförs. PGT‑A är inte en metod som ökar kvaliteten på embryon generellt. Ett problem med utfallsmåttet alla embryoåterföringar från ett ägguttag är att embryon kan vara nedfrusna under lång tid innan de återförs. Därför har man i flera studier av pragmatiska skäl begränsat uppföljningen till en viss tid efter ägguttaget, men denna tid kan i vissa fall vara tämligen kort. Hur denna tid har begränsats har påverkat vår bedömning av risk för bias för utfallet. Vårt andra primära utfallsmått, förlossningar med levande barn per randomiserad kvinna efter första planerade embryoåterföringen, som även det visar på jämförbar andel förlossningar med levande barn för IVF med och utan PGT‑A, saknar dessa nackdelar.
Det kan teoretiskt verka märkligt att IVF med PGT‑A inte leder till att fler barn föds än vid IVF utan PGT‑A. Våra resultat skulle dock kunna förklaras av att en större andel av de som gör IVF med PGT‑A inte får någon embryoåterföring än de som gör IVF utan PGT‑A och att vissa av de embryon som valts bort efter PGT‑A hade kunnat leda till att ett levande barn fötts [9]. I studierna som ingår i vår analys har vanligen endast euploida embryon återförts medan mosaiska embryon valts bort (Faktaruta 2.2). Nya studier visar att även mosaiska embryon kan ge upphov till graviditet och barn, men i lägre omfattning än euploida embryon [10] [159] [160], utan ökad sannolikhet för kromosomavvikelser eller skador hos barnen [9] [10]. Även otydliga analysresultat och feldiagnostik kan ha lett till att embryon som kunde ha lett till ett levande fött barn inte återförts vid PGT‑A. Det är också teoretiskt möjligt att biopsin av embryot påverkar embryots möjlighet att ge upphov till graviditet. Detta är dock svårt att utvärdera. I litteraturen finns enstaka studier som jämfört resultat mellan återföring av biopserade respektive icke biopserade embryon som tyder på att biopsi dag 3 då embryot har 6–10 celler kan resultera i en lägre graviditetsfrekvens, men att biopsi på blastocyststadiet (dag 5) inte verkar påverka embryots förmåga att ge upphov till graviditet och förlossningar med levande barn [161]. Detta är troligen relaterat till att i blastocyststadiet är andelen celler som tas ut lägre och att de celler som då tas ut inte är de som ger upphov till fostret utan de som till exempel bildar moderkakan.
Vi har även utvärderat effekten av IVF med PGT‑A för kvinnor 35 år och äldre eftersom äldre kvinnor har en större andel aneuploida embryon [52], vilket är en orsak till att de generellt har svårare att få barn. Med en större andel aneuploida embryon blir risken högre att ett embryo med aneuploidi återförs när PGT‑A inte görs än om andelen varit lägre som hos yngre kvinnor. Detta leder också till att för äldre kvinnor som gör PGT‑A är det färre som får en embryoåterföring än för yngre kvinnor (Appendix 5) [75] [76].Teoretiskt skulle äldre kvinnor, framför allt äldre kvinnor med många embryon, kunna ha en större nytta av IVF med PGT‑A. Men inte heller för kvinnor 35 år och äldre har vi kunnat identifiera någon högre förlossningsfrekvens vid tillägg av PGT‑A. Resultatet för denna grupp är dock mer osäkert än för hela populationen eftersom resultatet för ett av de primära utfallen, förlossningar med levande barn efter första planerade embryoåterföring, var alltför osäkert för att vi skulle kunna dra några slutsatser. I två av de inkluderade studierna ingick en ännu äldre population, de inkluderade enbart kvinnor som var 38 till 41 år [75] respektive 36 till 40 år [76]. Ingen av dessa studier fann dock en ökad förlossningsfrekvens efter PGT‑A när resultaten analyserades per randomiserad kvinna.
Vi planerade även att utvärdera effekten av IVF med PGT‑A för andra populationer, som kvinnor med upprepade missfall eller upprepade misslyckade IVF-behandlingar, men det saknades randomiserade studier för dessa grupper.
När enbart kvinnor med en genomförd embryoåterföring inkluderades i analyserna förefaller andelen förlossningar med levande barn öka i gruppen som gjort IVF med PGT‑A, både för hela populationen och för kvinnor 35 år och äldre. Resultatet för detta utfall bekräftar teorin bakom PGT‑A, det vill säga att om man enbart återför embryon med normalt antal kromosomer så ökar chansen till förlossning med levande barn. Dock ger detta sekundära utfall inte den sanna bilden av effekten av insatsen PGT‑A eftersom kvinnor som genomgår IVF med PGT‑A har en ökad risk att inte få någon embryoåterföring alls jämfört med de som gör IVF utan PGT‑A. Detta inträffar om samtliga embryon visar sig vara aneuploida. En korrekt utvärdering av effekten av IVF med PGT‑A jämfört med IVF utan PGT‑A ska därför inkludera samtliga kvinnor som genomgår IVF och där PGT‑A utförts, oberoende av om kvinnan sedan fått en embryoåterföring eller inte.
Det finns en stor mängd observationsstudier om effekten av IVF med PGT‑A, varav majoriteten enbart redovisar förlossningar med levande barn för de med en genomförd embryoåterföring. Dessutom är det i observationsstudier ofta en skillnad mellan de patienter som erbjuds respektive väljer en viss behandling och dessa skillnader kan påverka resultatet. I denna översikt inkluderas enbart RCT-studier för att utvärdera effekten av PGT‑A, eftersom randomisering till behandlingsgrupp minskar risken för att kända och okända faktorer som skiljer patientgrupperna åt påverkar resultatet. Totalt har tio RCT-studier publicerats som utvärderar effekten av IVF med eller utan PGT‑A med de moderna genetiska tekniker som analyserar samtliga kromosomer. Brister i hur tre av dessa studier lagts upp eller redovisats ledde till att endast sju RCT-studier kunde inkluderas i vår översikt. Detta kan tyckas vara ett litet antal RCT-studier för en teknik som funnits i flera decennier, men beror till viss del på att tidiga RCT-studier utvärderade effekten av PGT‑A med den genetiska tekniken FISH som endast analyserar en andel av kromosomerna. Dessa studier saknar relevans i dagsläget då denna teknik inte längre används vid PGT‑A. Det har också visats att PGT‑A analys med FISH troligen ger sämre förlossningsresultat än IVF utan PGT‑A [18], vilket bidrog till att vi valde att enbart inkludera studier som analyserat samtliga kromosomer i vår översikt.
Våra resultat stämmer väl överens med slutsatser från olika fertilitetsorganisationer som skrivit rekommendationer inom området. Varken ESHRE (European Society of Human Reproduction and Embryology) [162], ASRM (American Society of Reproductive Medicine) [163] eller HFEA (Human Fertilisation and Embryology Authority) [164] rekommenderar PGT‑A generellt. För specifika patientgrupper, såsom äldre kvinnor, anger ASRM och HFEA att kunskapsläget är oklart. Det finns ett stort antal systematiska översikter om effekten av PGT‑A med varierande resultat. Flertalet av dessa har brister som gör dem mindre relevanta eller påverkar hur tillförlitliga de är. Brister som vi identifierat är undermåliga litteratursökningar, att de lagt in resultat för olika typer av utfall i samma metaanalys [78] [85], endast rapporterar graviditet eller förlossningar med levande barn för de med en genomförd embryoåterföring, endast summerar observationsstudier, blandar resultat från RCT-studier med observationsstudier eller inkluderar studier som vi uteslutit på grund av bristande relevans eller oacceptabelt hög risk för bias. Ett undantag är Cornelisse från år 2020 [18] som rapporterar förlossningar med levande barn för alla kvinnor som randomiserats i studierna. De finner i likhet med vår översikt ingen påvisbar fördel för IVF med PGT‑A när samtliga kromosomer analyseras i den genetiska analysen, men resultaten är osäkra eftersom få studier hade inkluderats.
Effekten av IVF med PGT‑A för andra utfall än förlossningar
Helt aneuploida embryon ger i regel inte upphov till graviditet och aneuploidi är en vanlig orsak till missfall [20] [165] . Eftersom färre embryon med aneuploidier återförs vid IVF med PGT‑A är det rimligt att anta att andelen missfall per klinisk graviditet skulle minska. Resultatet för missfall var dock i våra analyser alltför osäkert för att kunna dra några slutsatser. Endast fem studier redovisar andelen missfall och det låga antalet missfall per klinisk graviditet i studierna bidrar till resultatets statistiska osäkerhet. Det behövs större välgjorda randomiserade studier för att fastställa om andelen missfall per klinisk graviditet påverkas av tillägg av PGT‑A vid IVF.
Tiden från att IVF-behandlingar påbörjas till förlossning är en viktig faktor. Detta gäller särskilt för äldre kvinnor eftersom kvinnans möjlighet att bli gravid avtar med ökande ålder. Teoretiskt skulle PGT‑A vid IVF kunna minska den totala behandlingstiden till förlossning om man snabbare kan återföra de embryon som har störst chans att leda till ett levande fött barn. Tiden till förlossning utvärderades bara i två av de inkluderade studierna på ett sätt som inte medförde en oacceptabelt hög risk för bias [56] [76], och ingen av studierna visade på någon skillnad avseende den totala behandlingstiden till förlossning efter IVF med eller utan PGT‑A. Resultaten kunde dock inte vägas samman och vi har därmed inte kunnat dra några slutsatser kring utfallet. Fler studier behövs för att bedöma om PGT‑A kan förkorta den totala behandlingstiden till förlossning vid IVF.
I den kvalitativa litteraturen har det framkommit att vissa patienter anser att en fördel med PGT‑A skulle kunna vara att undvika att barn föds med kromosomavvikelser samt minska behovet av att göra fosterdiagnostik [146]. Det är en liten andel barn som föds med kromosomavvikelser efter IVF-behandling, i likhet med vid spontan graviditet [166]. Vi har inte utvärderat om IVF med PGT‑A leder till färre födda barn med kromosomavvikelser och vi har inte heller funnit några studier som utvärderat detta specifikt. Det är också oklart om behovet av uppföljande fosterdiagnostik minskar efter PGT‑A eftersom tydliga rekommendationer gällande detta saknas. Ett annat möjligt användningsområde för PGT‑A som lyfts av professionen inom reproduktionsmedicin är som en del i en utredning om orsaken till infertiliteten för par med upprepade misslyckade IVF-behandlingar. Nyligen publicerade data hittar dock ingen association mellan aneuploidi och upprepade misslyckade behandlingar [52].
Komplikationer relaterade till biopsi av embryot
Genetisk diagnostik av embryon med biopsi är en invasiv metod som teoretiskt kan leda till komplikationer för barnet och den gravida kvinnan. För den gravida kvinnan har vi särskilt fokuserat på de komplikationer som anses vara kopplade till moderkakan [40], eftersom det främst är celler som bidrar till utvecklingen av moderkakan (trofektodermceller) som tas ut vid biopsi av embryon i senare stadium av embryoutvecklingen. I denna översikt såg vi inget som tyder på några skillnader vid IVF med eller utan biopsi, varken för perinatala komplikationer, komplikationer relaterade till moderkakan för kvinnan eller långtidsutfall för barnen. Vi kunde dock inte bedöma tillförlitligheten eller dra några slutsatser för dessa utfall eftersom studierna skilde sig för mycket åt. Andra systematiska översikter från senare år har visat liknande resultat [79] [82] [86], även om en något ökad risk för graviditetshypertoni har identifierats i två av översikterna [79] [86]. En trolig orsak till denna skillnad är att vi har inkluderat fler studier än de andra översikterna samt att de inkluderat studier som vi bedömt har oacceptabelt hög risk för bias. Dessa studier som vi uteslutit har bland annat inte särredovisat barn födda i enkelbörd, vilket är viktigt eftersom flerbördsgraviditeter ger högre risk för komplikationer för barnet och den gravida kvinnan.
Aspekter relaterade till de hälsoekonomiska resultaten
Den systematiska översikten av hälsoekonomisk litteratur visade på många och allvarliga metodologiska brister bland de flesta relevanta studierna, vilket gjorde att de inte kunde inkluderas i resultaten. Detta tyder på en suboptimal användning av forskningsresurser på området. De två inkluderade studierna var genomförda i Kina respektive USA, och kan förväntas ha en låg överförbarhet till ett svenskt sammanhang om PGT‑A skulle göras tillgängligt i Sverige. I båda länderna föreligger andra finansieringssystem för IVF än i Sverige, och praxis inom fertilitetsområdet skiljer sig från svensk behandlingspraxis.
Mot bakgrund av hur viktigt det lokala sammanhanget är för de hälsoekonomiska resultaten konstruerades en hälsoekonomisk modell som baserades på effektdata från den systematiska översikten och svenska data kring kostnader och utfall med IVF. Viktiga ingångsvärden i modellen är kostnaden för PGT‑A samt effekten på andelen förlossningar med levande barn. Utifrån resultaten av den systematiska översikten av PGT‑A visar de hälsoekonomiska analyserna att PGT‑A leder till en ökad kostnad för själva metoden, utan att leda till någon ökning av andelen förlossningar med levande barn; detta gäller oavsett kvinnornas ålder. Våra känslighetsanalyser visar även att effekten av PGT‑A spelar en central roll för resultaten av kostnadseffektivitetsanalysen.
Aspekter att ta hänsyn till inom framtida svensk vård
I Sverige är PGT endast tillåtet om mannen eller kvinnan bär på anlag för en allvarlig ärftlig sjukdom, eftersom man när lagen skrevs ansåg att risken för eventuella komplikationer och kostnader kunde vägas upp av nyttan av att undvika att föda ett svårt sjukt barn, eller behöva genomgå en abort. Däremot var kunskapsunderlaget avseende PGT‑A vid lagens tillkomst dåligt och det ansågs inte vara godtagbart att tillåta genetisk testning av embryon för en hypotetisk, men inte bevisad, förbättring av resultaten efter IVF [29]. Trots ett idag förbättrat kunskapsläge visar denna översikt att det fortfarande inte finns några tydliga fördelar av IVF med PGT‑A. Vi ser inga indikationer på att IVF med biopsi för PGT leder till mer komplikationer, men det är tydligt att IVF med PGT‑A innebär att kostnaden för en IVF-behandling7 ökar med cirka 38 000 kronor.
7. En IVF-behandling avser ett ägguttag och den första embryoåterföringen.
De studier som inkluderats i denna rapport är alla baserade på embryobiopsi. Upptäckten att mediet som embryona odlas i innehåller cellfritt DNA från embryot som kan användas för genetisk analys har lett till utvecklingen av PGT‑A utan embryobiopsi, så kallad icke-invasiv PGT‑A (non-invasive PGT‑A; niPGT‑A). Detta innebär potentiellt att metoden kan bli både billigare och metodologiskt enklare. Det saknas dock helt RCT-studier där effekten utvärderats för IVF med icke-invasiv PGT‑A jämfört med IVF utan PGT‑A och vi identifierade endast en RCT-studie som jämfört PGT‑A med biopsi och icke-invasiv PGT‑A [134]. I likhet med PGT‑A med biopsi så är inte heller icke-invasiv PGT‑A idag tillåten i Sverige.
Området assisterad reproduktion utvecklas fort, med krav på förbättrade resultat från både utförare och patienter. Det finns en rad olika tester och behandlingar som kan läggas till standardbehandlingen (så kallade tilläggsbehandlingar, add-ons) och användandet liksom omfattningen varierar mellan olika kliniker och länder. I många fall används dessa utan vare sig biologisk hypotes, evidens om metodens effekt, eller tillräcklig information om metodens säkerhet. Både ESHRE och HFEA definierar i nuläget PGT‑A som ett tillägg till standardbehandlingen som inte bör ingå i klinisk rutin [164]. Både hos patienter och inom professionen finns förväntningar på olika typer av tilläggsbehandlingar, som kanske inte kommer uppfyllas. Förväntningarna kan ibland bero på att en teoretiskt tilltalande hypotes ligger till grund för metoden, som i fallet PGT‑A. Den starka önskan att få barn kan göra att patientgruppen är extra utsatt och mottaglig för marknadsföring i de fall då tilläggsbehandlingar marknadsförs som att det verkar säkerställt att de har avsedd effekt. Det är därför av stor vikt att patienter i vården ges information som är korrekt och heltäckande, vilket också återspeglas av de juridiska processer som pågår i bland annat USA gällande vilseledande marknadsföring kring effekten av PGT‑A [32].
Frånvaron av PGT‑A i utredningsarsenalen får en del svenska patienter att vända sig till andra länder där metoden är tillåten. Flera av dessa kliniker återför ofta två embryon vid samma tillfälle till skillnad från i Sverige där det är standard att återföra ett embryo per tillfälle. Detta kan resultera i riskabla flerbördsgraviditeter, vilka sedan får hanteras av svensk sjukvård. Detta är dock inte ett skäl för att införa en metod i Sverige som är resurskrävande och saknar påvisad patientnytta. Varje land måste själva ta ställning till vilka metoder som ska användas i sjukvården.
Om IVF med PGT‑A trots avsaknad av påvisad patientnytta framgent skulle tillåtas i Sverige bör man bland annat ta hänsyn till potentiella undanträngningseffekter av annan vård. Vid en eventuell framtida översyn av lagstiftningen på området kan det också behövas en analys av vad det skulle innebära för personer med funktionsnedsättningar att PGT‑A tillåts och används. En sådan översyn kan även behöva beakta hur andra möjligheter att välja ut embryon vid IVF, exempelvis utifrån kön eller framtida sjukdomsrisk, ska regleras och hanteras av professionen.
9.2 Metoddiskussion
Skillnader mellan studierna som utvärderar effekten av PGT‑A vid IVF
Metoderna som används vid IVF och vid PGT‑A varierar mellan studierna. Vi har slagit samman studier med olika biopsidagar, färska respektive frysta embryon och skillnader i hantering av mosaicism, även om vi är medvetna om att resultaten kan påverkas av dessa skillnader. Vi har bedömt att skillnaderna inte är så pass stora att det påverkar tillförlitligheten till vårt sammanvägda resultat. PGT‑A tekniken har förändrats mycket genom åren vilket också kan bidra till skillnader i resultat mellan studierna. Vi har därför sett det som naturligt att studierna skiljer sig åt i vissa aspekter. Heterogeniteten mellan studierna kan också ses som en styrka och öka generaliserbarheten då vi genom att inkludera alla studierna i metaanalyserna utvärderat PGT‑A tekniken i sin helhet.
Även studieupplägget har varierat mellan studierna. Bland annat varierade tidpunkten för randomisering, vilken bör vara så nära interventionen som möjligt, i det här fallet biopsin av embryot. I en studie randomiserade man redan vid start av behandlingscykeln, vilket orsakade problem med många uteslutna patienter eftersom en behandlingscykel kan avbrytas av flera olika orsaker som leder till att inga embryon för biopsi finns att tillgå (Figur 2.1) [75]. Utfallet andel förlossningar med levande barn per ägguttag har utvärderats på olika sätt i studierna, eftersom man av pragmatiska skäl har begränsat uppföljningen till en viss tid efter ägguttaget. Eftersom jämförelsegrupperna behandlats på liknande sätt har vi ändå bedömt att resultaten från studierna kan vägas samman.
Vi har uteslutit studier där man planerat att återföra olika antal embryon i de två jämförelsegrupperna eftersom dessa studier inte bara utvärderar effekten av PGT‑A utan även effekten av att återföra olika antal embryon [71] [72]. I några av de inkluderade studierna där lika många embryon per återförande tilläts i jämförelsegrupperna skiljde sig dock antalet återförda embryon mellan grupperna till följd av att PGT‑A utfördes [55] [65] [75] [76] . Att antalet embryon till återförande blir färre efter IVF med PGT‑A ingår i PGT‑A metoden eftersom den leder till att färre embryon, men av högre potential, återförs.
Bedömning av effekten av IVF med eller utan PGT‑A
Vi har utgått ifrån effektstorleken och konfidensintervallet i metaanalyserna för att bedöma om det är en skillnad eller om effekten är jämförbar mellan grupperna. För att bedöma hur tillförlitliga våra resultat är har vi gjort känslighetsanalyser där varje enskild studie uteslutits en i taget [36]. Om detta lett till att vår tolkning av resultatet förändrats från att det är en skillnad till att det är en jämförbar effekt, eller tvärtom, har vi landat i en mycket låg tillförlitlighet för resultatet. Detta eftersom det inte går att bedöma om ett resultat stämmer när det påverkas så starkt av en enskild studie.
Hantering av problem relaterade till komplikationsstudierna
Det är troligt att vi kan ha missat relevanta studier om komplikationer eftersom dessa studier är svårare att identifiera. Vi kan ha missat studier i litteratursökningen, särskilt studier som beskriver senare barnkomplikationer efter tiden runt förlossningen eftersom dessa är svåra att söka efter på ett uttömmande sätt. Vi kan även ha missat att inkludera studier som beskriver komplikationer efter IVF med eller utan PGT, om det i artikelsammanfattningen inte framgått att man redovisar komplikationer eller en jämförelse mellan IVF med och utan PGT. Risken för detta är sannolikt störst för studier som inte fann någon skillnad mellan grupperna eftersom den typen av resultat ofta inte lyfts i artikelsammanfattningar. Trots detta har vi i vår översikt inkluderat över 100 relevanta studier som beskriver komplikationer, vilket är långt fler än vad andra systematiska översikter på området hittat.
För att få en så heltäckande bild som möjligt av komplikationer orsakade av biopsi av embryon inkluderade vi komplikationer för såväl PGT av ärftliga orsaker som PGT‑A, trots att det är välkänt att infertiliteten i sig är förenad med vissa komplikationer. Patienter som genomgår PGT‑A har en infertilitet, medan detta vanligen inte är fallet för de som genomgår PGT-M och PGT-SR. Vidare inkluderades både RCT-studier och observationsstudier eftersom flertalet studier avseende komplikationer generellt är retrospektiva observationsstudier. Vi har valt att göra en syntes utan metaanalys eftersom studierna skilde sig mycket åt vad gäller studiedesign, populationer som undersöktes och hur IVF-behandlingen genomfördes. Resultaten redovisas också i vissa fall som ojusterade data och i andra fall som justerade data där man tagit hänsyn till olika störfaktorer. På grund av den stora variationen mellan studierna redovisar vi endast andelen studier som visar på fler komplikationer i PGT eller kontrollgruppen, men drar inga slutsatser gällande eventuella skillnader mellan grupperna eftersom resultatens tillförlitlighet inte bedömts.
Modellering och ingående data i den hälsoekonomiska analysen
Ett grundläggande krav för hälsoekonomiska utvärderingar är tydlighet i modellstruktur och antaganden, vilket en stor del av litteraturen på det här området inte uppfyller. Alla förutom en av de studier som uppfyllde inklusionskriterierna hade använt sig av beslutsträd. Trots att den typen av modell kan verka enklare än andra typer av hälsoekonomiska modeller, finns ett antal utmanade aspekter att ta hänsyn till vid modellering av effekterna av PGT‑A. En utmaning består i att få till en rättvisande och tydlig struktur som kan ta hänsyn till de olika tidsperioderna över vilka andelen förlossningar med levande barn mäts i de kliniska studierna. Faktumet att andelen förlossningar med levande barn kan rapporteras per planerad embryoåterföring och per genomförd embryoåterföring betyder att resultaten från kliniska studier och systematiska översikter måste tolkas noggrant för att kunna användas korrekt i modellen.
Vi har i vår analys begränsat oss till den första planerade embryoåterföringen. För att göra en heltäckande hälsoekonomisk utvärdering av resultatet från ett ägguttag – som kan omfatta både den färska behandlingscykeln och eventuella frysta behandlingscykler – hade vi behövt använda resultatet för alla embryoåterföringar från ett ägguttag. I kliniska studier är det ofta svårt att fånga resultatet från ett ägguttag, eftersom antalet tillgängliga embryon varierar och/eller antalet återföringar begränsas för att kunna genomföra studien inom en fastlagd tidsperiod. Eftersom resultatet från den systematiska översikten var detsamma för båda effektmåtten, skulle resultatet från en hälsoekonomisk analys för alla embryoåterföringar från ett ägguttag vara detsamma, det vill säga att PGT‑A leder till ökade kostnader utan att antalet förlossningar med levande barn ökar. Det går utifrån nuvarande forskning inte att uttala sig om huruvida det totala antalet återföringar till en förlossning med levande barn ändras vid användning av PGT‑A. Om det skulle visa sig att detta ändras med PGT‑A, skulle det påverka den totala kostnaden för IVF-behandlingen om alla embryoåterföringar från ett ägguttag inkluderades i den hälsoekonomiska analysen.
Förutom att tydliggöra händelseförloppet och visa kostnaderna relaterade till olika utfall vid IVF med och utan PGT‑A ger den hälsoekonomiska modellen möjligheten att genomföra känslighetsanalyser med olika antaganden kring effekt. Dessa analyser visade att det övergripande resultatet gällande kostnadseffektiviteten speglar spridningen i resultatet av den systematiska översikten, där våra känslighetsanalyser även inkluderar det icke-signifikanta medelvärdet för det primära utfallsmåttet.
Utfallsmått i ekonomiska utvärderingar på området
Det finns en del utmaningar kring ekonomiska utfallsmått inom fertilitetsområdet. I litteraturen framhålls att det är konceptuellt och etiskt problematiskt att använda det annars vanliga måttet kvalitetsjusterade levnadsår (QALYs) för att bedöma värdet av ännu inte existerande liv. Medicinska insatser går generellt ut på att rädda, förlänga eller förbättra ett befintligt liv, medan det inom fertilitet generellt gäller skapandet av ett nytt liv. Istället har kostnadsintäktsanalyser (cost-benefit analysis) föreslagits som alternativ för den här typen av utvärderingar. Detta kräver i så fall information om samhällets betalningsvilja för en ökning på marginalen av möjligheten att få ett levande fött barn [167] [168]. Beroende på perspektiv kan det finnas olika uppfattningar om betalningsviljan för en sådan ökning. För patienter kan den hypotetiska betalningsviljan för en marginell ökning vara avsevärt högre än för beslutsfattare som har i uppdrag att fördela begränsade resurser mellan olika grupper med vitt åtskilda behov. Eftersom den systematiska översikten inte visade någon ökning av andelen förlossningar med levande barn har det i denna rapport inte varit relevant att relatera resultatet i den hälsoekonomiska analysen till betalningsviljan.
Val av perspektiv i den hälsoekonomiska analysen
I vår hälsoekonomiska analys har vi använt ett hälso- och sjukvårdsperspektiv, där endast direkta medicinska kostnader inkluderas. I Sverige står regionerna för kostnaden för upp till tre IVF-behandlingar (tre ägguttag och samtliga påföljande embryoåterföringar) eller till ett barn föds. Inom privat vård står patienterna för alla kostnader, förutom läkemedel. Vid ett samhällsperspektiv inkluderas alla kostnader oavsett vem som betalar; utöver de medicinska kostnaderna tillkommer icke-medicinska direkta kostnader (exempelvis resekostnader till behandlingskliniken) och indirekta kostnader för produktionsbortfall, som kan tänkas vara betydande vid upprepade IVF-försök. Som tidigare påpekats är de hälsoekonomiska analyserna endast utförda för den första planerade återföringen. Eftersom den systematiska översikten inte kunde påvisa någon effekt av PGT‑A på andelen förlossningar med levande barn (varken för den första planerade återföringen eller alla återföringar från ett ägguttag), skulle ett vidare samhällsperspektiv i det här fallet ändå inte ändra det övergripande resultatet av de hälsoekonomiska analyserna.
10. Överväganden för forskning
Det finns behov av mer forskning för att utvärdera om PGT-A har effekt till exempel vad gäller den totala behandlingstiden till förlossning och om det finns någon patientgrupp som särskilt skulle ha nytta av PGT-A. Det finns också ett behov av ett mer enhetligt upplägg på framtida studier och att utfallen redovisas i enlighet med ett framtaget core outcome set gällande forskning om infertilitet [11].
De inkluderade studierna som utvärderar effekten av IVF med PGT-A skiljer sig åt både vad gäller upplägg och vilka utfallsmått som redovisas, vilket försvårar utvärdering av nyttan. Det är relativt få RCT-studier som utvärderat effekten av PGT-A, vilket bidragit till brister i resultatens precision. Det finns därför ett behov av fler stora randomiserade studier som utvärderar andel förlossningar med levande barn för alla som randomiseras i studierna oavsett om de får en återföring eller inte.
Ett viktigt utfallsmått är den totala behandlingstiden till förlossning. På senare år har det lyfts fram att PGT-A skulle kunna ha en möjlig positiv effekt på detta utfallsmått särskilt om embryon rangordnas och återförs i en viss ordning utifrån PGT-A-resultaten, men inte helt selekteras bort som man gjort med mosaiska embryon i vissa inkluderade studier. Om detta kan korta tiden till förlossning med levande barn skulle det kunna vara fördelaktigt, framför allt för kvinnor i det äldre åldersspannet. Detta utfallsmått har dock inte studerats tillräckligt och det saknas helt RCT-studier som enbart rangordnat embryona och inte selekterat bort vissa embryon. Det behövs därför RCT-studier som utvärderar tid till förlossning med ett studieupplägg som återspeglar det sätt som behandlingen skulle läggas upp i den kliniska verkligheten, om målet är att minska den totala behandlingstiden till förlossning. I detta sammanhang bör även antalet embryoåterföringar som behövs till en förlossning med levande barn redovisas tydligt för att möjliggöra en rättvisande beräkning av kostnader för den totala IVF-behandlingen.
Teoretiskt finns det vissa patientgrupper som kan antas ha en större nytta av PGT-A. Den vanligaste indikationen för PGT-A har varit hög ålder hos kvinnan (advanced maternal age, AMA) eftersom andelen aneuploida embryon ökar med kvinnans ålder. Trots detta så finns det få studier om hur PGT-A fungerar för gruppen kvinnor 38 år och äldre. Det är möjligt att äldre kvinnor med många embryon är de som skulle kunna ha nytta av PGT-A, varför fler studier eller subgruppsanalyser av till exempel kvinnor som är 38 år eller äldre vore önskvärda. Vi har identifierat protokoll för sex pågående RCT-studier som utvärderar PGT-A vid hög ålder hos kvinnan. Andra patientgrupper som ansetts kunna ha en teoretisk nytta av PGT-A är kvinnor med upprepade missfall eller upprepade misslyckade IVF-behandlingar. Det pågår två RCT-studier för vardera patientgruppen baserat på de protokoll som vi identifierat.
Upplägget på framtida RCT-studier bör planeras så att utvärdering av nyttan underlättas. Bland annat är det viktigt att randomiseringen i studier som utvärderar PGT-A sker så nära inpå biopsin av embryot som möjligt. För att kunna sammanväga resultat och dra slutsatser om effekter är det önskvärt att framtida forskning utgår ifrån hur PGT-A används kliniskt i dagsläget, det vill säga biopsi i blastocyststadiet, biopsi på alla embryon från ett ägguttag som bedöms ha en god kvalitet, genetisk analys av samtliga kromosomer, återföring av ett embryo i taget i båda jämförelsegrupperna samt rangordning av embryon utifrån resultatet av PGT-A analysen med möjlighet att även återföra mosaiska embryon.
Det är inte sannolikt att icke-invasiv PGT-A har en bättre effekt på andel förlossningar med levande barn än PGT-A med embryobiopsi, men eftersom tekniken redan idag marknadsförs som ett tillägg till IVF behövs även forskning om denna teknik. Det är relativt stora variationer mellan studier när det gäller hur väl resultaten från den genetiska analysen överensstämmer mellan embryobiopsi och analys av cellfritt DNA från odlingsmediet, men det finns studier med lovande resultat [169]. Det saknas dock helt RCT-studier som utvärderar effekten av IVF med icke-invasiv PGT-A jämfört med IVF utan PGT-A. Detta är en viktig kunskapslucka eftersom sådana studier behövs för att kunna uttala sig om ifall IVF med icke-invasiv PGT-A ger några fördelar jämfört med enbart IVF. Det är också viktigt att även sådana studier utvärderar relevanta utfallsmått så som andel förlossningar med levande barn för alla kvinnor som randomiserats och den totala behandlingstiden till förlossning. Vid sökning i databaser efter protokoll för pågående studier identifierades tre pågående RCT-studier som utvärderar IVF med icke-invasiv PGT-A jämfört med IVF utan PGT-A.
11. Medverkande
11.1 Projektgrupp
11.1.1 Sakkunniga
- Christina Bergh, professor emeritus och överläkare inom obstetrik och gynekologi, Sahlgrenska Universitetssjukhuset och Västra Götalandsregionen, Göteborg
- Britt Friberg, docent och överläkare inom obstetrik och gynekologi, Lunds IVF Center, Lund
- Erik Iwarsson, docent och överläkare inom klinisk genetik, Karolinska universitetssjukhuset, Stockholm
- Kersti Lundin, docent och överbiolog, Göteborgs universitet, Göteborg
- Erik Malmqvist, docent i medicinsk etik och universitetslektor, Göteborgs universitet, Göteborg Kansli
11.1.2 Kansli
- Susanne Johansson, projektledare
- Fanny Sellberg, biträdande projektledare
- Jan Adolfsson, biträdande projektledare
- Maria Ahlberg, projektadministratör
- Jenny Berg, hälsoekonom
- Martina Lundqvist, hälsoekonom
- Maja Kärrman Fredriksson, informationsspecialist
- Jenny Ågren, projektmedarbetare
- Jenny Odeberg, projektansvarig chef
11.1.3 Externa granskare
- Thomas Davidson, docent, Linköpings universitet, Linköping
- Jan Holte, med dr och specialistläkare inom obstetrik och gynekologi, Carl von Linnékliniken, Uppsala
- Elizabeth Nedstrand, docent och specialistläkare inom obstetrik och gynekologi, Patientsäkerhetsenheten, Region Sörmland
- Nils-Eric Sahlin, professor emeritus, Lunds universitet, Lund
SBU anlitar externa granskare av sina rapporter. De har kommit med värdefulla kommentarer som förbättrat rapporten. SBU har dock inte alltid möjlighet att tillgodose alla ändringsförslag och de externa granskarna står därför inte med nödvändighet bakom samtliga slutsatser och texter i rapporten.
11.1.4 Bindningar och jäv
Sakkunniga och externa granskare har i enlighet med SBU:s krav lämnat deklarationer om bindningar och jäv. SBU har bedömt att de förhållanden som redovisats där är förenliga med myndighetens krav på saklighet och opartiskhet.
11.1.5 SBU:s vetenskapliga råd
- Anna Ehrenberg, Högskolan Dalarna, ordförande (omvårdnad)
- Katarina Steen Carlsson, Lunds universitet, vice ordförande (hälsoekonomi)
- Aron Naimi-Akbar, Malmö universitet (tandvård)
- Ata Ghaderi, Karolinska institutet (psykologi)
- Britt-Marie Stålnacke, Umeå universitet (medicin)
- Carina Berterö, Linköpings universitet (omvårdnad)
- Christina Nehlin Gordh, Uppsala universitet (psykiatri)
- Eva Uustal, Linköpings universitet (medicin)
- Jahangir Khan, Göteborgs universitet (hälsoekonomi)
- Lena Dahlberg, Högskolan Dalarna (socialt arbete)
- Magnus Svartengren, Uppsala universitet (arbetsmiljö)
- Martin Bergström, Lunds universitet (socialt arbete)
- Mussie Msghina, Örebro universitet (medicin)
- Petter Gustavsson, Karolinska institutet (psykologi)
- Susanne Guidetti, Karolinska institutet (arbetsterapi)
- Sverker Svensjö, Falun och Uppsala universitet (medicin)
- Titti Mattsson, Lunds universitet (etik, juridik)
- Ulrik Kihlbom, Karolinska institutet (etik)
- Urban Markström, Umeå universitet (socialt arbete, funktionstillstånd- och funktionshinder)
- Ylva Nilsagård, Örebro universitet (fysioterapi)
12. Ordförklaringar och förkortningar
| Aneuploidi | Avvikande antal kromosomer |
| Behandlingscykel | En behandlingsomgång vid IVF som startats med antingen hormoninjektioner för en färsk cykel med ägguttag och eventuell återföring av färskt embryo, eller en fryscykel med återföring av fryst embryo. |
| Betalningsvilja | Det man är villig att betala för en effektenhet. |
| Bias | Ett systematiskt fel (snedvridning) i en vetenskaplig studies upplägg eller genomförande som påverkar resultaten och inte beror på slumpfaktorer. |
| Biopsi | Prov av vävnad eller celler |
| Blastocyst | Embryo fem till sex dagar efter befruktningen, innehåller förstadium till fostret. |
| Direkta kostnader | Består huvudsakligen av kostnader för hälso- och sjukvård och omsorg, som exempelvis kostnader för läkemedel, personal, utrustning och förbrukningsmaterial. |
| Effektstorlek | Standardiserat statistiskt mått som anger styrkan på ett samband mellan två variabler. Anger storleken på effekten av en intervention, det vill säga skillnaden mellan två grupper. |
| Eklampsi | En form av havandeskapsförgiftning (preeklampsi) med kramper eller medvetandepåverkan. |
| Ektopisk graviditet | Utomkvedshavandeskap, när embryot implanterar (fäster) utanför livmodern. |
| Embryo | Ett befruktat ägg som börjat dela sig och fram till att de flesta organsystem bildats, cirka vecka 8. |
| Embryoåterföring | Införande av embryo till livmodern |
| Enkelbörd | En graviditet där endast ett foster utvecklas och ett barn föds. |
| Evidens | Forskningsresultat som är systematiskt sökta, relevans- och kvalitetsgranskade och sammanvägda eller på annat sätt sammanställda. |
| Euploidi | Komplett uppsättning kromosomer, 46 stycken för människor |
| FISH | Fluorescerande in-situ hybridisering, metod för att märka upp delar av kromosomer och därigenom identifiera genetiska förändringar. |
| Flerbörd | En graviditet där två eller flera foster utvecklas och två eller flera barn föds som tvillingar, trillingar, etc. |
| GRADE | GRADE står för Grading of Recommendations Assessment, Development and Evaluation. Modell för värdering av tillförlitligheten av resultat i systematiska översikter och andra forskningssammanställningar. |
| Graviditetshypertoni | Högt blodtryck som debuterar under graviditeten |
| Helgenomsekvensering | Analys av hela genomet, kallas även next generation sequencing (NGS) |
| Hälsoekonomi | Kunskapsområde där nationalekonomisk teori och metodik tillämpas på området hälsa. Omfattar bland annat ekonomiska utvärderingar inom hälso- och sjukvården och socialtjänsten. |
| Hälsoekonomisk modellanalys | Analysmetod för att genomföra hälsoekonomiska analyser. Data kan komma från olika källor som exempelvis interventionsstudier, register, epidemiologiska studier och prislistor. |
| Icke-invasiv | Åtgärd, behandling eller diagnostisk metod som inte involverar att man tränger in i kroppen eller i detta fall i embryot. |
| ICSI | Intracytoplasmatisk spermieinjektion, befruktning med injektion av en spermie i ägget. |
| Implantation | Fastväxt av det befruktade ägget till livmoderns slemhinna |
| Inklusionskriterium | Fastställda villkor som ska vara uppfyllda för att en person ska kunna delta i en studie, eller för att data från en publicerad primärstudie ska kunna tas med i en systematisk översikt. |
| Intervention | Åtgärd i syfte att åstadkomma en förändring. Ofta avses en behandlande eller stödjande insats. |
| Intrauterin fosterdöd | När fostret dör i livmodern efter 22 fullgångna graviditetsveckor |
| Invasiv | Åtgärd, behandling eller diagnostisk metod där instrument tränger in i kroppen eller i detta fall i embryot. |
| ITT-analys | ITT-analys står för Intention to treat analys. Analys utifrån den ursprungliga tilldelningen (randomiseringen) av en åtgärd/behandling. |
| IVF | In vitro-fertilisering, också kallat provrörsbefruktning, befruktning utanför kvinnans kropp. |
| Justerad analys | Tar hänsyn till andra faktorer som kan påverka resultatet. |
| Klinisk graviditet | Graviditet som säkerställts med ultraljud |
| Konfidensintervall | Osäkerhetsintervall för en statistisk skattning (till exempel ett medelvärde). |
| Kontrollgrupp | Jämförelsegrupp som inte får den insats som studeras. |
| Kostnadseffektivitet | Hur mycket man på marginalen behöver betala för en extra effektenhet. |
| Kostnadseffektivitetsanalys | Hälsoekonomisk analysmetod där kostnader och effekter av två eller fler insatser jämförs och vars resultat presenteras som en inkrementell kostnadseffektkvot (ICER). |
| Kromosomavvikelse | Avvikelser från det normala antalet kromosomer eller från den normala strukturen på kromosomerna. |
| Kumulativ förlossningsfrekvens vid IVF | Andel kvinnor som uppnår minst en förlossning med ett levande barn efter ett ägguttag. Omfattar resultatet från en färsk embryoåterföring och samtliga frysta embryoåterföringar från ett ägguttag, eller om inget lämpligt embryo fanns ingen embryoåterföring. |
| Kvalitativ studie | Vetenskaplig studie med kvalitativ forskningsmetodik som syftar till att skapa förståelse av företeelser så som upplevelser, erfarenheter eller attityder, och som bygger på information från till exempel intervjuer, observationer eller textanalys. |
| Kvalitetsjusterat levnadsår | (Engelska: quality-adjusted life-year, QALY). Hälsoekonomiskt utfallsmått som väger samman livslängd och hälsorelaterad livskvalitet. |
| Metaanalys | Statistisk metod för att sammanväga resultat från flera studier |
| Monozygota tvillingar | Enäggstvillingar, tvillingar som utvecklats från samma befruktade ägg. |
| Morfologi | Utseende, i detta fall på embryot |
| Morfologisk bedömning | Embryot graderas vid en mikroskopisk bedömning i förhållande till uppställda kriterier, till exempel vad gäller antalet celler och cellernas utseende. Embryon som bedöms ha en god kvalitet vid den morfologiska bedömningen har större chans att implantera i livmodern. |
| Mosaicism | En blandning av normala celler och celler med en avvikande kromosomuppsättning i till exempel ett embryo. |
| Observationsstudie | I en observationsstudie studeras deltagarna utan påverkan från de som utför studien. |
| Oddskvot | (Engelska: Odds Ratio, OR) Statistiskt mått som används för att undersöka hur något förhåller sig till något annat. Odds inom statistik anger hur troligt det är att en händelse inträffar (antal fall där en händelse inträffar (A) /antal fall där en händelse inte inträffar (B)). Oddskvot jämför oddset för en händelse med oddset för en annan händelse. (OR = (A/B) /(C/D)). |
| Paritet | Antal tidigare förlossningar för kvinnan. |
| Perinatala komplikationer | Komplikationer för barnet som uppstår inom den perinatala perioden. |
| Perinatal | Tiden närmast före, under och efter förlossningen. Ofta definierat som tiden från 22 fulla graviditetsveckor, under förlossningen och en vecka efter förlossningen. |
| PGD | Preimplantatorisk genetisk diagnostik, tidigare använt samlingsnamn för PGT-M och PGT-SR. PGD är ett alternativ till traditionell fosterdiagnostik och innebär diagnostik av en ärftlig genetisk sjukdom (PGT-M) eller kromosomavvikelse (PGT-SR) redan på embryostadiet, innan graviditet har påbörjats. |
| PGT | Preimplantatorisk genetisk testning, samlingsnamn för genetisk analys av embryon som kan utföras i samband med IVF. Innefattar PGT-A, PGT-M, PGT, SR, PGT-HLA och PGT-P (se Faktaruta 2.1). |
| PGT-A | Preimplantatorisk genetisk testning för aneuploidi, är en form av genetisk diagnostik av antalet kromosomer som kan göras innan embryot återförs vid IVF. |
| PICO | PICO står för Population, Intervention, Control, Outcome. Svenska: population, insats, jämförelse / kontroll, utfall. Strukturerat format för frågeställningar som gäller effekten av en insats. En strukturerad frågeställning underlättar sökningar i databaser och bedömning av vilka studier som är relevanta. |
| Placenta accreta | Moderkakan växer in i muskulaturen i livmodern och släpper inte som den ska vid förlossningen. |
| Placenta percreta | Moderkakan växer igenom livmoderväggen |
| Placenta previa | Moderkakan täcker öppningen till livmoderhalsen och ligger i vägen för barnet vid förlossningen. |
| Placentaavlossning | Moderkaksavlossning, moderkakan lossnar från livmoderväggen innan förlossning. |
| Polkroppar | Små celler inuti det befruktade ägget som innehåller kromosomer från kvinnan. Försvinner en tid efter att de bildats. |
| Population | Den grupp som studeras i ett forskningsprojekt, till exempel alla med ett visst tillstånd eller problem, eller alla som bor i en viss geografisk region. |
| Postpartumblödning | Onormal blödning efter förlossning |
| Preeklampsi | Havandeskapsförgiftning, graviditetskomplikation som inkluderar högt blodtryck och äggvita i urinen, med eller utan svullnad. |
| Prospektiv | Man studerar händelser framåt i tiden. |
| Punktestimat | Medelvärde, medianvärde, också punktskattning i ett stickprov |
| Randomisering | Slumpmässig fördelning av deltagare till grupperna i en kontrollerad eller jämförande studie. |
| RCT | (Engelska: Randomised Controlled Trial). Svenska: randomiserad kontrollerad studie. Vetenskaplig studie där deltagarna slumpmässigt delas in olika grupper. En grupp får en viss insats, en annan grupp får inte insatsen. |
| Retrospektiv | Man studerar händelser bakåt i tiden. |
| Riskkvot | (Engelska: Risk Ratio, RR) Relativt mått som jämför risken (sannolikheten) för en händelse i förhållande till risken för en annan händelse alternativt risken för en händelse i två olika grupper. |
| Riskskillnad | (Engelska: Risk Difference, RD) Absolut mått på skillnader i risk, till exempel mellan två grupper. |
| Störfaktor | Confounder eller förväxlingsfaktor som man måste ta hänsyn till eftersom den riskerar att snedvrida resultatet vid analys av det undersökta orsakssambandet. |
| Systematisk översikt | Sammanställning av resultat från vetenskapliga undersökningar som med systematiska och tydligt beskrivna metoder har identifierats, valts ut och bedömts kritiskt och som avser en specifikt formulerad forskningsfråga. |
| Trofektoderm | Yttre cellager i embryot som senare bildar vävnader som stöder embryots tillväxt och utvecklas till moderkakan. |
| Utfall | Alla tänkbara resultat från en studie. Det kan vara resultat av en förebyggande, stödjande eller behandlande insats, eller resultat av en exponering. |
| Ägguttag | Ägg tas ut från kvinnans äggstockar med en tunn nål via slidan vid IVF. |
13. Referenser
- WHO. Infertility Prevalence Estimates, 1990–2021. World Health Organization Team Sexual and Reproductive Health and Research (SRH); 2023. [accessed May 22 2025]. Available from: https://www.who.int/publications/i/item/978920068315.
- Bergh C, Kluge L. Fertilitetsbehandlingar i Sverige. Årsrapport 2024. Gäller behandlingar startade 2022. RESULTAT – TRENDER – ÖPPNA JÄMFÖRELSER. Göteborg: Q-IVF Nationellt kvalitetsregister för assisterad befruktning; 2024. [accessed April 22 2025]. Available from: https://www.medscinet.com/qivf/uploads/hemsida/%C3%85rsrapport%202024%20Final%20version%202.pdf.
- Steptoe PC, Edwards RG. Birth after the reimplantation of a human embryo. Lancet. 1978;2(8085):366. Available from: https://doi.org/10.1016/s0140-6736(78)92957-4.
- Adamson GD, Creighton P, de Mouzon J, Zegers-Hochschild F, Dyer S, Chambers GM. How many infants have been born with the help of assisted reproductive technology? Fertil Steril. 2025. Available from: https://doi.org/10.1016/j.fertnstert.2025.02.009.
- SFOG. Ofrivillig barnlöshet. Svensk förening för obstetrik och gynekologi Arbets- och referensgrupp för ofrivillig barnlöshet; 2010 Report nr 64. [accessed April 22 2025]. Available from: https://www.sfog.se/natupplaga/ARG64d1c6ef01-208e-4626-9b8f-b0da564c61d9.pdf.
- SFOG. Reproduktionsmedicin. Stockholm: Svensk förening för obstetrik och gynekologi Arbets- och referensgrupp för ofrivillig barnlöshet; 2019 Report nr 81. [accessed April 22 2025]. Available from: https://www.sfog.se/natupplaga/ARG81_LR8f508dc3-aec0-45fe-9efc-58a2b2873e50.pdf.
- Handyside AH, Pattinson JK, Penketh RJ, Delhanty JD, Winston RM, Tuddenham EG. Biopsy of human preimplantation embryos and sexing by DNA amplification. Lancet. 1989;1(8634):347-9. Available from: https://doi.org/10.1016/s0140-6736(89)91723-6.
- Volovsky M, Scott RT, Jr., Seli E. Non-invasive preimplantation genetic testing for aneuploidy: is the promise real? Hum Reprod. 2024;39(9):1899-908. Available from: https://doi.org/10.1093/humrep/deae151.
- Barad DH, Albertini DF, Molinari E, Gleicher N. IVF outcomes of embryos with abnormal PGT-A biopsy previously refused transfer: a prospective cohort study. Human Reproduction. 2022;37(6):1194-206. Available from: https://doi.org/10.1093/humrep/deac063.
- Viotti M, Greco E, Grifo JA, Madjunkov M, Librach C, Cetinkaya M, et al. Chromosomal, gestational, and neonatal outcomes of embryos classified as a mosaic by preimplantation genetic testing for aneuploidy. Fertil Steril. 2023;120(5):957-66. Available from: https://doi.org/10.1016/j.fertnstert.2023.07.022.
- Duffy JMN, Bhattacharya S, Bhattacharya S, Bofill M, Collura B, Curtis C, et al. Standardizing definitions and reporting guidelines for the infertility core outcome set: an international consensus development study∗†. Fertility and Sterility. 2021;115(1):201-12. Available from: https://doi.org/10.1016/j.fertnstert.2020.11.013.
- Zegers-Hochschild F, Adamson GD, Dyer S, Racowsky C, de Mouzon J, Sokol R, et al. The International Glossary on Infertility and Fertility Care, 2017. Fertility and Sterility. 2017;108(3):393-406. Available from: https://doi.org/10.1016/j.fertnstert.2017.06.005.
- Saket Z, Källén K, Lundin K, Magnusson Å, Bergh C. Cumulative live birth rate after IVF: trend over time and the impact of blastocyst culture and vitrification. Human Reproduction Open. 2021;2021(3). Available from: https://doi.org/10.1093/hropen/hoab021.
- Consensus TWGotuotEAI, Coticchio G, Ahlström A, Arroyo G, Balaban B, Campbell A, et al. The Istanbul consensus update: a revised ESHRE/ALPHA consensus on oocyte and embryo static and dynamic morphological assessment†,‡. Human Reproduction. 2025. Available from: https://doi.org/10.1093/humrep/deaf021.
- Glujovsky D, Quinteiro Retamar AM, Alvarez Sedo CR, Ciapponi A, Cornelisse S, Blake D. Cleavage-stage versus blastocyst-stage embryo transfer in assisted reproductive technology. Cochrane Database Syst Rev. 2022;5(5):Cd002118. Available from: https://doi.org/10.1002/14651858.CD002118.pub6.
- Kokkali G, Coticchio G, Bronet F, Celebi C, Cimadomo D, Goossens V, et al. ESHRE PGT Consortium and SIG Embryology good practice recommendations for polar body and embryo biopsy for PGT. Hum Reprod Open. 2020;2020(3):hoaa020. Available from: https://doi.org/10.1093/hropen/hoaa020.
- De Vos A, Staessen C, De Rycke M, Verpoest W, Haentjens P, Devroey P, et al. Impact of cleavage-stage embryo biopsy in view of PGD on human blastocyst implantation: a prospective cohort of single embryo transfers. Human Reproduction. 2009;24(12):2988-96. Available from: https://doi.org/10.1093/humrep/dep251.
- Cornelisse S, Zagers M, Kostova E, Fleischer K, van Wely M, Mastenbroek S. Preimplantation genetic testing for aneuploidies (abnormal number of chromosomes) in in vitro fertilisation. Cochrane Database Syst Rev. 2020;9(9):Cd005291. Available from: https://doi.org/10.1002/14651858.CD005291.pub3.
- Zhang X, Zheng PS. Mechanism of chromosomal mosaicism in preimplantation embryos and its effect on embryo development. J Assist Reprod Genet. 2024;41(5):1127-41. Available from: https://doi.org/10.1007/s10815-024-03048-2.
- Tiegs AW, Tao X, Zhan Y, Whitehead C, Kim J, Hanson B, et al. A multicenter, prospective, blinded, nonselection study evaluating the predictive value of an aneuploid diagnosis using a targeted next-generation sequencing-based preimplantation genetic testing for aneuploidy assay and impact of biopsy. Fertility and sterility. 2021;115(3):627-37. Available from: https://doi.org/10.1016/j.fertnstert.2020.07.052.
- De Rycke M, Capalbo A, Coonen E, Coticchio G, Fiorentino F, Goossens V, et al. ESHRE survey results and good practice recommendations on managing chromosomal mosaicism. Hum Reprod Open. 2022;2022(4):hoac044. Available from: https://doi.org/10.1093/hropen/hoac044.
- Leigh D, Cram DS, Rechitsky S, Handyside A, Wells D, Munne S, et al. PGDIS position statement on the transfer of mosaic embryos 2021. Reprod Biomed Online. 2022;45(1):19-25. Available from: https://doi.org/10.1016/j.rbmo.2022.03.013.
- SFS 2006:2006:351. Lag (2006:351) om genetisk integritet m.m. Svensk författningssamling. Sveriges riksdag Socialdepartementet. [Available from: https://www.riksdagen.se/sv/dokument-och-lagar/dokument/svensk-forfattningssamling/lag-2006351-om-genetisk-integritet-m.m_sfs-2006-351/.
- Socialstyrelsen 2009:4 kap. 7 § Socialstyrelsens föreskrifter och allmänna råd (SOSFS 2009:32) om användning av vävnader och celler i hälso- och sjukvården och vid klinisk forskning. Socialstyrelsen. [accessed April 22 2025]. Available from: https://www.socialstyrelsen.se/kunskapsstod-och-regler/regler-och-riktlinjer/foreskrifter-och-allmanna-rad/konsoliderade-foreskrifter/200932-om-anvandning-av-vavnader-och-celler-i-halso--och-sjukvarden-och-vid-klinisk-forskning/.
- SKR. Assisterad befruktning Uppföljningsrapport med definitioner, rekommendationer och utvecklingsområden. Stockholm: Sveriges Kommuner och Regioner,; 2014 Version 2. [accessed April 22 2025]. Available from: https://skr.se/download/18.1f376ad3177c89481f73e1af/1615204927279/SKL_assisterad_befruktning_uppfoljningsrapport_052014.pdf.
- SKR. Rekommendation om enhetlighet i regionernas erbjudande av offentlig finansierad assisterad befruktning (revidering 2). Stockholm: Sveriges Kommuner och Regioner; 2020. [accessed April 22 2025]. Available from: https://skr.se/download/18.32563d7d1784aa279ecac6bb/1618304676440/Rekommendation-assisterad%20befruktning-ver2-nov2020.pdf.
- Socialstyrelsen. Preimplantatorisk genetisk diagnostik. Stockholm: Socialstyrelsen,; 2021. [accessed April 22 2025]. Available from: https://www.socialstyrelsen.se/kunskapsstod-och-regler/regler-och-riktlinjer/nationell-hogspecialiserad-vard/oversikt/preimplantatorisk-genetisk-diagnostik/.
- Bergh C, Kluge L. Göteborg: Q-IVF Nationellt kvalitetsregister för assisterad befruktning. [accessed April 22 2025]. Available from: https://www.medscinet.com/qivf/.
- Socialdepartementet Genetisk integritet m.m. Prop. 2005/06:64. Stockholm: Regeringskansliet. [accessed April 22 2025]. Available from: https://www.regeringen.se/rattsliga-dokument/proposition/2006/01/prop.-20050664.
- The European IVF-Monitoring Consortium (EIM) for the European Society of Human Reproduction and Embryology (ESHRE), C Calhaz-Jorge, J Smeenk, C Wyns, D De Neubourg, D P Baldani, C Bergh, I Cuevas-Saiz, Ch De Geyter, M S Kupka, K Rezabek, A Tandler-Schneider, V Goossens, Survey on ART and IUI: legislation, regulation, funding, and registries in European countries—an update, Human Reproduction, Volume 39, Issue 9, September 2024, Pages 1909–1924. Available from: https://doi.org/10.1093/humrep/deae163.
- SART National summary report. Preliminary National Summary Report for 2022. [accessed April 2022 2025]. Available from: https://www.sartcorsonline.com/CSR/Public?ClinicPKID=0&reportingYear=2022.
- Ducharme J. IVF Patients Say a Test Caused Them to Discard Embryos. Now They’re Suing. Time. 2025. Available from: https://time.com/7264271/ivf-pgta-test-lawsuit/.
- Tzortzatos G, Pettersson K, Edelstam G, Wånggren K. Cross Border Reproductive Care (CBRC). SFOG; 2019. [accessed March 20 2024]. Available from: https://www.sfog.se/media/336803/cross-border-reproductive-care.pdf.
- Capalbo A, de Wert G, Mertes H, Klausner L, Coonen E, Spinella F, et al. Screening embryos for polygenic disease risk: a review of epidemiological, clinical, and ethical considerations. Human Reproduction Update. 2024;30(5):529-57. Available from: https://doi.org/10.1093/humupd/dmae012.
- Thurin A, Hausken J, Hillensjö T, Jablonowska B, Pinborg A, Strandell A, et al. Elective single-embryo transfer versus double-embryo transfer in in vitro fertilization. N Engl J Med. 2004;351(23):2392-402. Available from: https://doi.org/10.1056/NEJMoa041032.
- SBU. Utvärdering av metoder i hälso- och sjukvården och insatser i socialtjänsten: en metodbok. Stockholm: Statens beredning för medicinsk och social utvärdering (SBU); 2020. [accessed 15 jun 2020]. Available from: https://www.sbu.se/sv/metod/metodboken-2023/.
- Moher D, Liberati A, Tetzlaff J, Altman DG. Preferred reporting items for systematic reviews and meta-analyses: the PRISMA statement. PLoS Med. 2009;6(7):e1000097. Available from: https://doi.org/10.1371/journal.pmed.1000097.
- Bergh C, Lundin K, Iwarsson E, Friberg B, Malmqvist E, Johansson S, et al. Effectiveness and complications of preimplantation genetic testing for aneuploidies (PGT-A) in in vitro fertilisation (IVF). 2024. PROSPERO. Available from: https://www.crd.york.ac.uk/PROSPERO/view/CRD42024529876
- [Effectiveness and complications of preimplantation genetic testing for aneuploidies (PGT-A) in in vitro fertilisation (IVF)]. International HTA Database. [Available from: https://database.inahta.org/article/23916.
- Magee LA, Nicolaides KH, von Dadelszen P. Preeclampsia. N Engl J Med. 2022;386(19):1817-32. Available from: https://doi.org/10.1056/NEJMra2109523.
- The EndNote Team. EndNote. Philadelphia, PA: Clarivate; 2013.
- Bramer WM, Giustini D, de Jonge GB, Holland L, Bekhuis T. De-duplication of database search results for systematic reviews in EndNote. J Med Libr Assoc. 2016;104(3):240-3. Available from: https://doi.org/10.3163/1536-5050.104.3.014.
- Covidence. Covidence systematic review software. Melbourne, Australia: Veritas Health Innovation. Available from: www.covidence.org.
- Sterne J, Hernán M, McAleenan A, Reeves B, Higgins J. Chapter 25: Assessing risk of bias in a non-randomized study [last updated October 2019]. In: Higgins JPT, Thomas J, Chandler J, Cumpston M, Li T, Page MJ, Welch VA (editors). Cochrane Handbook for Systematic Reviews of Interventions version 6.5. Cochrane, 2024. Available from cochrane.org/handbook.
- Frick AP. Advanced maternal age and adverse pregnancy outcomes. Best Pract Res Clin Obstet Gynaecol. 2021;70:92-100. Available from: https://doi.org/10.1016/j.bpobgyn.2020.07.005.
- Giuffrè M, Piro E, Corsello G. Prematurity and twinning. J Matern Fetal Neonatal Med. 2012;25 Suppl 3:6-10. Available from: https://doi.org/10.3109/14767058.2012.712350.
- Koullali B, van Zijl MD, Kazemier BM, Oudijk MA, Mol BWJ, Pajkrt E, et al. The association between parity and spontaneous preterm birth: a population based study. BMC Pregnancy and Childbirth. 2020;20(1):233. Available from: https://doi.org/10.1186/s12884-020-02940-w.
- Lean SC, Derricott H, Jones RL, Heazell AEP. Advanced maternal age and adverse pregnancy outcomes: A systematic review and meta-analysis. PLoS One. 2017;12(10):e0186287. Available from: https://doi.org/10.1371/journal.pone.0186287.
- Shah PS. Parity and low birth weight and preterm birth: a systematic review and meta-analyses. Acta Obstet Gynecol Scand. 2010;89(7):862-75. Available from: https://doi.org/10.3109/00016349.2010.486827.
- Siristatidis C, Papapanou M, Karageorgiou V, Martins WP, Bellos I, Teixeira DM, et al. Congenital anomaly and perinatal outcome following blastocyst- vs cleavage-stage embryo transfer: systematic review and network meta-analysis. Ultrasound in Obstetrics & Gynecology. 2023;61(1):12-25. Available from: https://doi.org/10.1002/uog.26019.
- Zaat T, Zagers M, Mol F, Goddijn M, van Wely M, Mastenbroek S. Fresh versus frozen embryo transfers in assisted reproduction. Cochrane Database Syst Rev. 2021;2(2):Cd011184. Available from: https://doi.org/10.1002/14651858.CD011184.pub3.
- Cimadomo D, Capalbo A, Dovere L, Tacconi L, Soscia D, Giancani A, et al. Leave the past behind: women's reproductive history shows no association with blastocysts' euploidy and limited association with live birth rates after euploid embryo transfers. Hum Reprod. 2021;36(4):929-40. Available from: https://doi.org/10.1093/humrep/deab014.
- Review Manager (RevMan). The Cochrane Collaboration. Available from: https://revman.cochrane.org/info.
- Higgins J, Thomas J, Chandler J, Cumpston M, Li T, Page M, et al. Cochrane Handbook for Systematic Reviews of Interventions version 6.5 (updated August 2024). Cochrane; 2024. [accessed April 23 2025]. Available from: www.training.cochrane.org/handbook.
- Wang L, Wang X, Li M, Liu Y, Ou X, Chen L, et al. PGT-A: The biology and hidden failures of randomized control trials. Prenatal Diagnosis. 2022;42(9):1211-21. Available from: https://doi.org/10.1002/pd.6199.
- Yan J, Qin Y, Zhao H, Sun Y, Gong F, Li R, et al. Live Birth with or without Preimplantation Genetic Testing for Aneuploidy. The New England journal of medicine. 2021;385(22):2047-58. Available from: https://doi.org/10.1056/NEJMoa2103613.
- McKenzie J, Brennan S. Chapter 12: Synthesizing and presenting findings using other methods [last updated October 2019]. In: Higgins J, Thomas J, Chandler J, Cumpston M, Li T, Page M, et al., editors. Cochrane Handbook for Systematic Reviews of Interventions version 65: Cochrane; 2024. Available from: https://training.cochrane.org/handbook/current/chapter-12.
- Kato K, Kuroda T, Yamadera-Egawa R, Ezoe K, Aoyama N, Usami A, et al. Preimplantation Genetic Testing for Aneuploidy for Recurrent Pregnancy Loss and Recurrent Implantation Failure in Minimal Ovarian Stimulation Cycle for Women Aged 35–42 Years: Live Birth Rate, Developmental Follow-up of Children, and Embryo Ranking. Reproductive Sciences. 2023;30(3):974-83. Available from: https://doi.org/10.1007/s43032-022-01073-z.
- Kato K, Ezoe K, Onogi S, Ito S, Egawa R, Aoyama N, et al. Comparison of 1-year cumulative live birth and perinatal outcomes following single blastocyst transfer with or without preimplantation genetic testing for aneuploidy: a propensity score-matched study. Journal of assisted reproduction and genetics. 2023;40(11):2669-80. Available from: https://doi.org/10.1007/s10815-023-02926-5.
- Belva F, Kondowe F, De Vos A, Keymolen K, Buysse A, Hes F, et al. Cleavage-stage or blastocyst-stage embryo biopsy has no impact on growth and health in children up to 2 years of age. Reproductive Biology and Endocrinology. 2023;21(1):87. Available from: https://doi.org/10.1186/s12958-023-01140-3.
- Guyatt GH, Oxman AD, Vist GE, Kunz R, Falck-Ytter Y, Alonso-Coello P, et al. GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. BMJ. 2008;336(7650):924. Available from: https://doi.org/10.1136/bmj.39489.470347.AD.
- SBU. Bilaga 8 Mall för kvalitetsgranskning av hälsoekonomiska modellstudier. In: Utvärdering av insatser i hälso- och sjukvården och socialtjänsten: En metodbok. Stockholm: Statens beredning för medicinsk och social utvärdering (SBU); 2023. [accessed April 23 2025]. Available from: https://www.sbu.se/globalassets/ebm/mall_modell_halsoekonomi.pdf.
- Munne S, Kaplan B, Frattarelli JL, Child T, Nakhuda G, Shamma FN, et al. Preimplantation genetic testing for aneuploidy versus morphology as selection criteria for single frozen-thawed embryo transfer in good-prognosis patients: a multicenter randomized clinical trial. Fertility and sterility. 2019;112(6):1071-9.e7. Available from: https://doi.org/10.1016/j.fertnstert.2019.07.1346.
- Ozgur K, Berkkanoglu M, Bulut H, Yoruk GDA, Candurmaz NN, Coetzee K. Single best euploid versus single best unknown-ploidy blastocyst frozen embryo transfers: a randomized controlled trial. Journal of Assisted Reproduction and Genetics. 2019;36(4):629-36. Available from: https://doi.org/10.1007/s10815-018-01399-1.
- Scott Jr RT, Upham KM, Forman EJ, Hong KH, Scott KL, Taylor D, et al. Blastocyst biopsy with comprehensive chromosome screening and fresh embryo transfer significantly increases in vitro fertilization implantation and delivery rates: A randomized controlled trial. Fertility and Sterility. 2013;100(3):697-703. Available from: https://doi.org/10.1016/j.fertnstert.2013.04.035.
- Utomregional prislista samt för EU/EES och Schweiz. Karolinska Universitetssjukhuset,; 2024. [accessed April 23 2025]. Available from: https://www.regionstockholm.se/491c61/contentassets/6f0275ce70be462193c2480734710703/bilaga-2-utomregional-prislista-karolinska-universitetssjukhuset-2024.pdf.
- Besök på barnmorskemottagningen. Region Stockholm: 1177. [accessed April 2023 2025]. Available from: https://www.1177.se/Stockholm/barn--gravid/graviditet/undersokningar-under-graviditeten/besok-pa-barnmorskemottagningen/.
- Socialstyrelsen. Prospektiva viktlistor och statistik om NordDRG. Stockholm: Socialstyrelsen,. [accessed April 23 2025]. Available from: https://www.socialstyrelsen.se/statistik-och-data/klassifikationer-och-koder/drg/viktlistor/.
- Socialstyrelsen. Statistik om graviditeter, förlossningar och nyfödda. Stockholm: Socialstyrelsen,. [accessed April 23 2025]. Available from: https://www.socialstyrelsen.se/statistik-och-data/statistik/alla-statistikamnen/graviditeter-forlossningar-och-nyfodda/.
- SBU. Etiska aspekter på insatser inom hälso- och sjukvården: En vägledning för att identifiera relevanta etiska aspekter. In. Stockholm: Statens beredning för medicinsk och social utvärdering (SBU); 2021. [accessed Feb 29 2024]; p. 1-17. Available from: https://www.sbu.se/globalassets/ebm/etiska_aspekter_halso_sjukvarden.pdf.
- Forman EJ, Hong KH, Ferry KM, Tao X, Taylor D, Levy B, et al. Invitro fertilization with single euploid blastocyst transfer: a randomized controlled trial. Fertility and Sterility. 2013;100(1):100-7.e1. Available from: https://doi.org/10.1016/j.fertnstert.2013.02.056.
- Sui YL, Lei CX, Ye JF, Fu J, Zhang S, Li L, et al. In vitro fertilization with single-Nucleotide polymorphism microarray-based preimplantation genetic testing for aneuploidy significantly improves clinical outcomes in infertile women with recurrent pregnancy loss: A randomized controlled trial. Reproductive and Developmental Medicine. 2020;4(1):32-41. Available from: https://doi.org/10.4103/2096-2924.281852.
- Yang Z, Liu J, Collins GS, Salem SA, Liu X, Lyle SS, et al. Selection of single blastocysts for fresh transfer via standard morphology assessment alone and with array CGH for good prognosis IVF patients: results from a randomized pilot study. Molecular Cytogenetics. 2012;5(1):24. Available from: https://doi.org/10.1186/1755-8166-5-24.
- Yang Z, Salem SA, Liu X, Kuang Y, Salem RD, Liu J. Selection of euploid blastocysts for cryopreservation with array comparative genomic hybridization (aCGH) results in increased implantation rates in subsequent frozen and thawed embryo transfer cycles. Molecular Cytogenetics. 2013;6(1):32. Available from: https://doi.org/10.1186/1755-8166-6-32.
- Rubio C, Bellver J, Rodrigo L, Castillon G, Guillen A, Vidal C, et al. In vitro fertilization with preimplantation genetic diagnosis for aneuploidies in advanced maternal age: a randomized, controlled study. Fertility and sterility. 2017;107(5):1122-9. Available from: https://doi.org/10.1016/j.fertnstert.2017.03.011.
- Verpoest W, Staessen C, Bossuyt PM, Goossens V, Altarescu G, Bonduelle M, et al. Preimplantation genetic testing for aneuploidy by microarray analysis of polar bodies in advanced maternal age: a randomized clinical trial. Human reproduction (Oxford, England). 2018;33(9):1767-76. Available from: https://doi.org/10.1093/humrep/dey262.
- Busnelli A, Somigliana E, Cirillo F, Baggiani A, Levi-Setti PE. Efficacy of therapies and interventions for repeated embryo implantation failure: a systematic review and meta-analysis. Scientific Reports. 2021;11(1):1747. Available from: https://doi.org/10.1038/s41598-021-81439-6.
- Cheng X, Zhang Y, Deng H, Feng Y, Chong W, Hai Y, et al. Preimplantation Genetic Testing for Aneuploidy With Comprehensive Chromosome Screening in Patients Undergoing In Vitro Fertilization: A Systematic Review and Meta-analysis. Obstetrics & Gynecology. 2022;140(5).
- Hou W, Shi G, Ma Y, Liu Y, Lu M, Fan X, et al. Impact of preimplantation genetic testing on obstetric and neonatal outcomes: a systematic review and meta-analysis. Fertility and Sterility. 2021;116(4):990-1000. Available from: https://doi.org/10.1016/j.fertnstert.2021.06.040.
- Kasaven LS, Marcus D, Theodorou E, Jones BP, Saso S, Naja R, et al. Systematic review and meta-analysis: does pre-implantation genetic testing for aneuploidy at the blastocyst stage improve live birth rate? Journal of Assisted Reproduction and Genetics. 2023;40(10):2297-316. Available from: https://doi.org/10.1007/s10815-023-02866-0.
- Liang Z, Wen Q, Li J, Zeng D, Huang P. A systematic review and meta-analysis: clinical outcomes of recurrent pregnancy failure resulting from preimplantation genetic testing for aneuploidy. Frontiers in Endocrinology. 2023;Volume 14 - 2023. Available from: https://doi.org/10.3389/fendo.2023.1178294.
- Mao D, Xu J, Sun L. Impact of trophectoderm biopsy for preimplantation genetic testing on obstetric and neonatal outcomes: a meta-analysis. American Journal of Obstetrics and Gynecology. 2024;230(2):199-212.e5. Available from: https://doi.org/10.1016/j.ajog.2023.08.010.
- Shi W-H, Jiang Z-R, Zhou Z-Y, Ye M-J, Qin N-X, Huang H-F, et al. Different Strategies of Preimplantation Genetic Testing for Aneuploidies in Women of Advanced Maternal Age: A Systematic Review and Meta-Analysis. Journal of Clinical Medicine. 2021;10(17):3895.
- Simopoulou M, Sfakianoudis K, Maziotis E, Tsioulou P, Grigoriadis S, Rapani A, et al. PGT-A: who and when? Α systematic review and network meta-analysis of RCTs. Journal of Assisted Reproduction and Genetics. 2021;38(8):1939-57. Available from: https://doi.org/10.1007/s10815-021-02227-9.
- Sordia-Hernandez LH, Morales-Martinez FA, González-Colmenero FD, Flores-Rodriguez A, Leyva-Camacho PC, Sordia-Piñeyro MO, et al. The Effects of Preimplantation Genetic Testing for Aneuploidy (PGT-A) on Patient-Important Outcomes in Embryo Transfer Cases: A Meta-Analysis. J Reprod Infertil. 2022;23(4):231-46. Available from: https://doi.org/10.18502/jri.v23i4.10808.
- Zheng W, Yang C, Yang S, Sun S, Mu M, Rao M, et al. Obstetric and neonatal outcomes of pregnancies resulting from preimplantation genetic testing: a systematic review and meta-analysis. Human Reproduction Update. 2021;27(6):989-1012. Available from: https://doi.org/10.1093/humupd/dmab027.
- Mastenbroek S, Twisk M, van Echten-Arends J, Sikkema-Raddatz B, Korevaar JC, Verhoeve HR, et al. In Vitro Fertilization with Preimplantation Genetic Screening. New England Journal of Medicine. 2007;357(1):9-17. Available from: https://doi.org/10.1056/NEJMoa067744.
- Meyer LR, Klipstein S, Hazlett WD, Nasta T, Mangan P, Karande VC. A prospective randomized controlled trial of preimplantation genetic screening in the "good prognosis" patient. Fertility and sterility. 2009;91(5):1731-8. Available from: https://doi.org/10.1016/j.fertnstert.2008.02.162.
- Staessen C, Platteau P, Van Assche E, Michiels A, Tournaye H, Camus M, et al. Comparison of blastocyst transfer with or without preimplantation genetic diagnosis for aneuploidy screening in couples with advanced maternal age: a prospective randomized controlled trial. Hum Reprod. 2004;19(12):2849-58. Available from: https://doi.org/10.1093/humrep/deh536.
- Staessen C, Verpoest W, Donoso P, Haentjens P, Van der Elst J, Liebaers I, et al. Preimplantation genetic screening does not improve delivery rate in women under the age of 36 following single-embryo transfer. Human Reproduction. 2008;23(12):2818-25. Available from: https://doi.org/10.1093/humrep/den367.
- Desmyttere S, De Schepper J, Nekkebroeck J, De Vos A, De Rycke M, Staessen C, et al. Two-year auxological and medical outcome of singletons born after embryo biopsy applied in preimplantation genetic diagnosis or preimplantation genetic screening. Human Reproduction. 2009;24(2):470-6. Available from: https://doi.org/10.1093/humrep/den402.
- Desmyttere S, De Rycke M, Staessen C, Liebaers I, De Schrijver F, Verpoest W, et al. Neonatal follow-up of 995 consecutively born children after embryo biopsy for PGD. Hum Reprod. 2012;27(1):288-93. Available from: https://doi.org/10.1093/humrep/der360.
- Winter C, Van Acker F, Bonduelle M, Desmyttere S, De Schrijver F, Nekkebroeck J. Cognitive and psychomotor development of 5- to 6-year-old singletons born after PGD: a prospective case–controlled matched study. Human Reproduction. 2014;29(9):1968-77. Available from: https://doi.org/10.1093/humrep/deu165.
- Winter C, Van Acker F, Bonduelle M, Desmyttere S, Nekkebroeck J. Psychosocial development of full term singletons, born after preimplantation genetic diagnosis (PGD) at preschool age and family functioning: a prospective case-controlled study and multi-informant approach. Human Reproduction. 2015;30(5):1122-36. Available from: https://doi.org/10.1093/humrep/dev036.
- Gulersen M, Peyser A, Ferraro A, Goldman R, Mullin C, Li X, et al. Maternal and neonatal outcomes in pregnancies conceived after preimplantation genetic testing. Prenatal Diagnosis. 2021;41(7):835-42. Available from: https://doi.org/10.1002/pd.5937.
- Hao Y, Long X, Kong F, Chen L, Chi H, Zhu X, et al. Maternal and neonatal outcomes following blastocyst biopsy for PGT in single vitrified–warmed embryo transfer cycles. Reproductive BioMedicine Online. 2022;44(1):151-62. Available from: https://doi.org/10.1016/j.rbmo.2021.07.016.
- Ji H, Zhang MQ, Zhou Q, Zhang S, Dong L, Li XL, et al. Trophectoderm biopsy is associated with adverse obstetric outcomes rather than neonatal outcomes. BMC Pregnancy Childbirth. 2023;23(1):141. Available from: https://doi.org/10.1186/s12884-023-05466-z.
- Lewis S, Amor DJ, Glynn A, Wilton L, Halliday J. Child health after preimplantation genetic testing. Reproductive BioMedicine Online. 2021;42(3):609-19. Available from: https://doi.org/10.1016/j.rbmo.2020.11.014.
- Li M, Kort J, Baker VL. Embryo biopsy and perinatal outcomes of singleton pregnancies: an analysis of 16,246 frozen embryo transfer cycles reported in the Society for Assisted Reproductive Technology Clinical Outcomes Reporting System. American Journal of Obstetrics & Gynecology. 2021;224(5):500.e1-.e18. Available from: https://doi.org/10.1016/j.ajog.2020.10.043.
- Li S, Ma S, Zhao J, Hu J, Li H, Zhu Y, et al. Non-Assisted Hatching Trophectoderm Biopsy Does Not Increase The Risks of Most Adverse Maternal and Neonatal Outcome and May Be More Practical for Busy Clinics: Evidence From China. Front Endocrinol (Lausanne). 2022;13:819963. Available from: https://doi.org/10.3389/fendo.2022.819963.
- Li Y, Wen Q, Liao J, Ma S, Zhang S, Gu Y, et al. Trophectoderm Biopsy Differentially Influences the Level of Serum β-Human Chorionic Gonadotropin With Different Embryonic Trophectoderm Scores in Early Pregnancy From 7847 Single-Blastocyst Transfer Cycles. Frontiers in Endocrinology. 2022;13. Available from: https://doi.org/10.3389/fendo.2022.794720.
- Lu M-m, Wen Y-x, Liu Y-l, Ding C-h, Zhou C-q, Xu Y-w. Trophectoderm biopsy reduces the level of serum beta-human chorionic gonadotropin in early pregnancy. Fertility and Sterility. 2020;114(4):801-8. Available from: https://doi.org/10.1016/j.fertnstert.2020.05.015.
- Makhijani R, Bartels CB, Godiwala P, Bartolucci A, DiLuigi A, Nulsen J, et al. Impact of trophectoderm biopsy on obstetric and perinatal outcomes following frozen–thawed embryo transfer cycles. Human Reproduction. 2021;36(2):340-8. Available from: https://doi.org/10.1093/humrep/deaa316.
- Nekkebroeck J, Bonduelle M, Desmyttere S, Van den Broeck W, Ponjaert-Kristoffersen I. Mental and psychomotor development of 2-year-old children born after preimplantation genetic diagnosis/screening. Human Reproduction. 2008;23(7):1560-6. Available from: https://doi.org/10.1093/humrep/den033.
- Nekkebroeck J, Bonduelle M, Desmyttere S, Van den Broeck W, Ponjaert-Kristoffersen I. Socio-emotional and language development of 2-year-old children born after PGD/PGS, and parental well-being. Human Reproduction. 2008;23(8):1849-57. Available from: https://doi.org/10.1093/humrep/den179.
- Ricciarelli E, Bruna I, Verdú V, Torrelló MJ, Herrer R, Gris JM, et al. Impact of assisted reproduction treatments on Spanish newborns: report of 14,119 pregnancies. Journal of Assisted Reproduction and Genetics. 2013;30(7):897-905. Available from: https://doi.org/10.1007/s10815-013-0023-0.
- Roeca C, Johnson R, Carlson N, Polotsky AJ. Preimplantation genetic testing and chances of a healthy live birth amongst recipients of fresh donor oocytes in the United States. Journal of Assisted Reproduction and Genetics. 2020;37(9):2283-92. Available from: https://doi.org/10.1007/s10815-020-01874-8.
- Sun N, Fang X, Jiao Y, Wang Y, Wan Y, Wu Z, et al. Adverse maternal and neonatal outcomes of preimplantation genetic testing with trophectoderm biopsy: a retrospective cohort study of 3373 intracytoplasmic sperm injection single frozen-thawed blastocyst transfer cycles. Arch Gynecol Obstet. 2024;309(6):2427-37. Available from: https://doi.org/10.1007/s00404-023-07120-7.
- Sunkara SK, Antonisamy B, Selliah HY, Kamath MS. Pre-term birth and low birth weight following preimplantation genetic diagnosis: analysis of 88 010 singleton live births following PGD and IVF cycles. Human Reproduction. 2017;32(2):432-8. Available from: https://doi.org/10.1093/humrep/dew317.
- Verpoest W, Van Landuyt L, Desmyttere S, Cremers A, Devroey P, Liebaers I. The incidence of monozygotic twinning following PGD is not increased. Human Reproduction. 2009;24(11):2945-50. Available from: https://doi.org/10.1093/humrep/dep280.
- Wu Y, Ying Y, Cao M, Liu J, Liu H. Trophectoderm biopsy of blastocysts for a preimplantation genetic test does not affect serum β-hCG levels in early pregnancy: a study using propensity score matching. Journal of Ovarian Research. 2021;14(1):78. Available from: https://doi.org/10.1186/s13048-021-00824-x.
- Zheng W, Ren B, Mu M, Liu Y, Liu X, Yang C, et al. Perinatal Outcomes of Singleton Live Births Following Preimplantation Genetic Testing for Chromosomal Structural Rearrangements in Single Frozen-Thawed Blastocyst Transfer Cycles: a Retrospective Cohort Study. Reprod Sci. 2022;29(10):3039-46. Available from: https://doi.org/10.1007/s43032-021-00732-x.
- Cozzolino M, Cecchino GN, Garcia Velasco JA, Pellicer N, Galliano D, Pellicer A. Preimplantation genetic testing for aneuploidy is not related to adverse obstetric and neonatal outcomes in singleton pregnancies. Human Reproduction. 2023;38(8):1621-7. Available from: https://doi.org/10.1093/humrep/dead123.
- Forman EJ, Tao X, Ferry KM, Taylor D, Treff NR, Scott RT, Jr. Single embryo transfer with comprehensive chromosome screening results in improved ongoing pregnancy rates and decreased miscarriage rates. Human Reproduction. 2012;27(4):1217-22. Available from: https://doi.org/10.1093/humrep/des020.
- Gulersen M, Peyser A, Kim J, Ferraro A, Goldman R, Mullin C, et al. The impact of preimplantation genetic testing for aneuploidy on prenatal screening. 2022;50(3):300-4. Available from: https://doi.org/10.1515/jpm-2021-0495.
- Liu D, Chen C, Huang Q, Dong Y, Xu L, Dong M, et al. Preimplantation genetic testing for complex chromosomal rearrangements: clinical outcomes and potential risk factors. Frontiers in Genetics. 2024;15. Available from: https://doi.org/10.3389/fgene.2024.1401549.
- Mejia RB, Capper EA, Summers KM, Mancuso AC, Sparks AE, Van Voorhis BJ. Cumulative live birth rate in women aged ≤37 years after in vitro fertilization with or without preimplantation genetic testing for aneuploidy: a Society for Assisted Reproductive Technology Clinic Outcome Reporting System retrospective analysis. F&S Reports. 2022;3(3):184-91. Available from: https://doi.org/10.1016/j.xfre.2022.05.004.
- Richardson H, Kalliora C, Mainigi M, Coutifaris C, Sammel MD, Senapati S. Impact of mode of conception on early pregnancy human chorionic gonadotropin rise and birth weight. F&S reports. 2022;3(1):13-9. Available from: https://doi.org/10.1016/j.xfre.2021.12.006.
- Riestenberg CK, Mok T, Ong JR, Platt LD, Han CS, Quinn MM. Sonographic abnormalities in pregnancies conceived following IVF with and without preimplantation genetic testing for aneuploidy (PGT-A). Journal of Assisted Reproduction and Genetics. 2021;38(4):865-71. Available from: https://doi.org/10.1007/s10815-021-02069-5.
- Sarkar P, New EP, Jindal S, Tanner JP, Imudia AN. The effect of trophectoderm biopsy for preimplantation genetic testing on fetal birth weight and preterm delivery. Minerva Obstet Gynecol. 2023. Available from: https://doi.org/10.23736/s2724-606x.22.05196-x.
- Shi X, Tang Y, Liu C, Li W, Lin H, Mao W, et al. Effects of NGS-based PGT-a for idiopathic recurrent pregnancy loss and implantation failure: a retrospective cohort study. Systems Biology in Reproductive Medicine. 2023;69(5):354-65. Available from: https://doi.org/10.1080/19396368.2023.2225679.
- Belva F, Roelants M, Kluijfhout S, Winter C, De Schrijver F, Desmyttere S, et al. Body composition and blood pressure in 6-year-old singletons born after pre-implantation genetic testing for monogenic and structural chromosomal aberrations: a matched cohort study. Human Reproduction Open. 2018;2018(4). Available from: https://doi.org/10.1093/hropen/hoy013.
- El-Toukhy T, Kamal A, Wharf E, Grace J, Bolton V, Khalaf Y, et al. Reduction of the multiple pregnancy rate in a preimplantation genetic diagnosis programme after introduction of single blastocyst transfer and cryopreservation of blastocysts biopsied on Day 3. Human Reproduction. 2009;24(10):2642-8. Available from: https://doi.org/10.1093/humrep/dep172.
- Feldman B, Orvieto R, Weisel M, Aizer A, Meyer R, Haas J, et al. Obstetric and Perinatal Outcomes in Pregnancies Conceived After Preimplantation Genetic Testing for Monogenetic Diseases. Obstetrics & Gynecology. 2020;136(4):782-91. Available from: https://doi.org/10.1097/aog.0000000000004062.
- Ginstrom Ernstad E, Hanson C, Wanggren K, Thurin-Kjellberg A, Hulthe Soderberg C, Syk Lundberg E, et al. Preimplantation genetic testing and child health: a national register-based study. Human reproduction (Oxford, England). 2023;38(4):739-50. Available from: https://doi.org/10.1093/humrep/dead021.
- Hasson J, Limoni D, Malcov M, Frumkin T, Amir H, Shavit T, et al. Obstetric and neonatal outcomes of pregnancies conceived after preimplantation genetic diagnosis: cohort study and meta-analysis. Reproductive BioMedicine Online. 2017;35(2):208-18. Available from: https://doi.org/10.1016/j.rbmo.2017.05.003.
- Snelgrove JW, Lee R, Jeyakumar Y, Greenblatt EM, Kingdom JC, Zwingerman R, et al. Maternal Placental Growth Factor (PlGF) levels, sonographic placental parameters, and outcomes of IVF pregnancies with and without embryo trophectoderm biopsy. Journal of assisted reproduction and genetics. 2024;41(10):2721-6. Available from: https://doi.org/10.1007/s10815-024-03193-8.
- Awadalla MS, Park KE, Latack KR, McGinnis LK, Ahmady A, Paulson RJ. Influence of Trophectoderm Biopsy Prior to Frozen Blastocyst Transfer on Obstetrical Outcomes. Reproductive Sciences. 2021;28(12):3459-65. Available from: https://doi.org/10.1007/s43032-021-00552-z.
- Eldar-Geva T, Srebnik N, Altarescu G, Varshaver I, Brooks B, Levy-Lahad E, et al. Neonatal outcome after preimplantation genetic diagnosis. Fertility and sterility. 2014;102(4):1016-21. Available from: https://doi.org/10.1016/j.fertnstert.2014.06.023.
- He H, Jing S, Lu CF, Tan YQ, Luo KL, Zhang SP, et al. Neonatal outcomes of live births after blastocyst biopsy in preimplantation genetic testing cycles: a follow-up of 1,721 children. Fertility and sterility. 2019;112(1):82-8. Available from: https://doi.org/10.1016/j.fertnstert.2019.03.006.
- Kamath M, Antonisamy B, Sunkara S. Zygotic splitting following embryo biopsy: a cohort study of 207 697 single-embryo transfers following IVF treatment. BJOG: An International Journal of Obstetrics & Gynaecology. 2020;127(5):562-9. Available from: https://doi.org/10.1111/1471-0528.16045.
- Liu AH-C, Shah T, Wu H, Lieman HJ, Singh M, Pollack SE, et al. Trophectoderm biopsy is associated with lower risks of moderate to extreme prematurity and low birthweights: a national registry cohort study of singleton livebirths from frozen-thawed blastocyst transfers. American journal of obstetrics and gynecology. 2024. Available from: https://doi.org/10.1016/j.ajog.2024.07.007.
- Sites CK, Bachilova S, Gopal D, Cabral HJ, Coddington CC, Stern JE. Embryo biopsy and maternal and neonatal outcomes following cryopreserved-thawed single embryo transfer. American Journal of Obstetrics and Gynecology. 2021;225(3):285.e1-.e7. Available from: https://doi.org/10.1016/j.ajog.2021.04.235.
- Sun Q, Xu J, Yao Y, Huang X, Zhao D, Lu S, et al. Efficacy of non-invasive chromosome screening, preimplantation genetic testing for aneuploidy, and morphological grading in selecting embryos of patients with advanced maternal age: a three-armed prospective cohort study. BMC pregnancy and childbirth. 2024;24(1):545. Available from: https://doi.org/10.1186/s12884-024-06736-0.
- Zhang WY, von Versen-Höynck F, Kapphahn KI, Fleischmann RR, Zhao Q, Baker VL. Maternal and neonatal outcomes associated with trophectoderm biopsy. Fertility and Sterility. 2019;112(2):283-90.e2. Available from: https://doi.org/10.1016/j.fertnstert.2019.03.033.
- Srebnik N, Sverdlik Kislasi Y, Amosi-Victor D, Rotshenker-Olshinka K, Eldar-Geva T, Ben-Ami I, et al. PGT pregnancies have a similar risk for post-partum complications as naturally conceived pregnancies. Reproductive BioMedicine Online. 2023;46(1):189-95. Available from: https://doi.org/10.1016/j.rbmo.2022.09.009.
- Zheng W, Yang SH, Yang C, Ren BN, Sun SM, Liu YL, et al. Perinatal outcomes of singleton live births after preimplantation genetic testing during single frozen-thawed blastocyst transfer cycles: a propensity score-matched study. Fertility and sterility. 2022;117(3):562-70. Available from: https://doi.org/10.1016/j.fertnstert.2021.12.020.
- SBU. 11. Ekonomiska aspekter. In: Utvärdering av metoder i hälso- och sjukvården och insatser i socialtjänsten: en metodbok. Stockholm: Statens beredning för medicinsk och social utvärdering (SBU); 2020. [accessed April 24 2025]. Available from: https://www.sbu.se/sv/metod/metodboken-2023/.
- He X, Wang X, Shen J, Wan B, Wang Y, Zhang Z, et al. Cost-effectiveness of preimplantation genetic testing for aneuploidy for women with subfertility in China: an economic evaluation using evidence from the CESE-PGS trial. BMC pregnancy and childbirth. 2023;23(1):254. Available from: https://doi.org/10.1186/s12884-023-05563-z.
- Collins SC, Xu X, Mak W. Cost-effectiveness of preimplantation genetic screening for women older than 37 undergoing in vitro fertilization. Journal of Assisted Reproduction and Genetics. 2017;34(11):1515-22. Available from: https://doi.org/10.1007/s10815-017-1001-8.
- Chang J, Boulet SL, Jeng G, Flowers L, Kissin DM. Outcomes of in vitro fertilization with preimplantation genetic diagnosis: an analysis of the United States Assisted Reproductive Technology Surveillance Data, 2011–2012. Fertility and Sterility. 2016;105(2):394-400. Available from: https://doi.org/10.1016/j.fertnstert.2015.10.018.
- Socialdepartementet Proposition 1996/97:60 Prioriteringar inom hälso- och sjukvården. Stockholm: Sveriges riksdag. [accessed April 25 2025]. Available from: https://www.riksdagen.se/sv/dokument-och-lagar/dokument/proposition/prioriteringar-inom-halso-och-sjukvarden_gk0360/.
- WHO. Infertility. [accessed 2025 May 22]. Available from: https://www.who.int/news-room/fact-sheets/detail/infertility.
- Elenkov A, Giwercman A, Søgaard Tøttenborg S, Bonde JPE, Glazer CH, Haervig KK, et al. Male childlessness as independent predictor of risk of cardiovascular and all-cause mortality: A population-based cohort study with more than 30 years follow-up. PLOS ONE. 2020;15(9):e0237422. Available from: https://doi.org/10.1371/journal.pone.0237422.
- Zhang J, Rubin LR, Zierhut H, Pastore LM. Comparison of Patients’ Ethical Perspectives of Preimplantation Embryo Genetic Testing for Aneuploidy (PGT-A) vs. Monogenic Disorders (PGT-M). Reproductive Sciences. 2021;28(11):3272-81. Available from: https://doi.org/10.1007/s43032-021-00644-w.
- Bracewell-Milnes T, Saso S, Jones B, Cato S, Parikh R, Thum MY, et al. A systematic review exploring the patient decision-making factors and attitudes towards pre-implantation genetic testing for aneuploidy and gender selection. Acta Obstet Gynecol Scand. 2021;100(1):17-29. Available from: https://doi.org/10.1111/aogs.13973.
- Kaing A, Rosen MP, Quinn MM. Perceptions, motivations and decision regret surrounding preimplantation genetic testing for aneuploidy. Hum Reprod. 2020;35(9):2047-57. Available from: https://doi.org/10.1093/humrep/deaa154.
- Quinn MM, Juarez-Hernandez F, Dunn M, Okamura RJ, Cedars MI, Rosen MP. Decision-making surrounding the use of preimplantation genetic testing for aneuploidy reveals misunderstanding regarding its benefit. J Assist Reprod Genet. 2018;35(12):2155-9. Available from: https://doi.org/10.1007/s10815-018-1337-8.
- Galiano V, Orvieto R, Machtinger R, Nahum R, Garzia E, Sulpizio P, et al. “Add-Ons” for Assisted Reproductive Technology: Do Patients Get Honest Information from Fertility Clinics’ Websites? Reproductive Sciences. 2021;28(12):3466-72. Available from: https://doi.org/10.1007/s43032-021-00601-7.
- Cheng L, Meiser B, Kennedy D, Kirk E, Barlow-Stewart K, Kaur R. Exploration of decision-making regarding the transfer of mosaic embryos following preimplantation genetic testing: a qualitative study. Hum Reprod Open. 2022;2022(4):hoac035. Available from: https://doi.org/10.1093/hropen/hoac035.
- The Disability Rights Critique of Prenatal Genetic Testing: Reflections and Recommendations. Hastings Center Report. 1999;29(5):s1-s24. Available from: https://doi.org/10.2307/3527746.
- Bayefsky MJ, Shaw J, Hamer D, Martel R, Reich J, Blakemore JK. A balancing act: sex selection after pre-implantation genetic testing for aneuploidy for first versus second baby. Human Reproduction. 2023;38(7):1325-31. Available from: https://doi.org/10.1093/humrep/dead101.
- Dondorp W, De Wert G, Pennings G, Shenfield F, Devroey P, Tarlatzis B, et al. ESHRE Task Force on ethics and Law 20: sex selection for non-medical reasons†. Human Reproduction. 2013;28(6):1448-54. Available from: https://doi.org/10.1093/humrep/det109.
- Barlevy D, Cenolli I, Campbell T, Furrer R, Mukherjee M, Kostick-Quenet K, et al. Patient interest in and clinician reservations on polygenic embryo screening: a qualitative study of stakeholder perspectives. Journal of Assisted Reproduction and Genetics. 2024;41(5):1221-31. Available from: https://doi.org/10.1007/s10815-024-03074-0.
- Furrer RA, Barlevy D, Pereira S, Carmi S, Lencz T, Lázaro-Muñoz G. Public Attitudes, Interests, and Concerns Regarding Polygenic Embryo Screening. JAMA Network Open. 2024;7(5):e2410832-e. Available from: https://doi.org/10.1001/jamanetworkopen.2024.10832.
- Lencz T, Sabatello M, Docherty A, Peterson RE, Soda T, Austin J, et al. Concerns about the use of polygenic embryo screening for psychiatric and cognitive traits. The Lancet Psychiatry. 2022;9(10):838-44. Available from: https://doi.org/10.1016/S2215-0366(22)00157-2.
- SMER. Smer föreslår: Tillsätt en utredning som tar fram en strategi för genteknikområdet och ser över lagstiftningen som skyddar människan. Statens medinsk-etiska råd; 2018. [accessed May 22 2025]. Available from: https://smer.se/wp-content/uploads/2018/06/Skrivelse-om-utredning-av-lagstiftning-f%C3%B6r-ny-genteknik.pdf.
- De Neubourg D, Bogaerts K, Blockeel C, Coetsier T, Delvigne A, Devreker F, et al. How do cumulative live birth rates and cumulative multiple live birth rates over complete courses of assisted reproductive technology treatment per woman compare among registries? Hum Reprod. 2016;31(1):93-9. Available from: https://doi.org/10.1093/humrep/dev270.
- Babariya D, Gill P, Ottolini CS, Mulas F, Picchetta L, Caroselli S, et al. O-155 Limited utility of mosaicism reporting in PGT-A: independent confirmation from a European multisite, double-blinded analysis including 4293 embryo transfers following the first US experience. Human Reproduction. 2024;39(Supplement_1). Available from: https://doi.org/10.1093/humrep/deae108.174.
- Spinella F, Greco E, Madjunkova S, Besser A, Biricik A, Listorti I, et al. O-154 Chromosomal, gestational, and neonatal outcomes of mosaic embryos: analysis of 3074 cases from the international registry of mosaic embryo. Human Reproduction. 2024;39(Supplement_1). Available from: https://doi.org/10.1093/humrep/deae108.173.
- Scott RT, Jr., Upham KM, Forman EJ, Zhao T, Treff NR. Cleavage-stage biopsy significantly impairs human embryonic implantation potential while blastocyst biopsy does not: a randomized and paired clinical trial. Fertil Steril. 2013;100(3):624-30. Available from: https://doi.org/10.1016/j.fertnstert.2013.04.039.
- Lundin K, Bentzen JG, Bozdag G, Ebner T, Harper J, Le Clef N, et al. Good practice recommendations on add-ons in reproductive medicine†. Hum Reprod. 2023;38(11):2062-104. Available from: https://doi.org/10.1093/humrep/dead184.
- ASRM. Washington, DC: American Society for Reproductive Medicine. [accessed April 25 2025]. Available from: https://www.asrm.org/practice-guidance/practice-committee-documents/the-use-of-preimplantation-genetic-testing-for-aneuploidy-a-committee-opinion-2024/.
- HFEA. Human Fertilisation and Embryology Authority. [accessed April 25 2025]. Available from: https://www.hfea.gov.uk/treatments/treatment-add-ons/pre-implantation-genetic-testing-for-aneuploidy-pgt-a/.
- Essers R, Lebedev IN, Kurg A, Fonova EA, Stevens SJC, Koeck RM, et al. Prevalence of chromosomal alterations in first-trimester spontaneous pregnancy loss. Nature Medicine. 2023;29(12):3233-42. Available from: https://doi.org/10.1038/s41591-023-02645-5.
- Berntsen S, Laivuori H, la Cour Freiesleben N, Loft A, Söderström-Anttila V, B Oldereid N, et al. A systematic review and meta-analysis on the association between ICSI and chromosome abnormalities. Human Reproduction Update. 2021;27(5):801-47. Available from: https://doi.org/10.1093/humupd/dmab005.
- Fenwick E, Eze A, D'Hooghe T, Pandey S, Chaudhari VS, Ostawal A, et al. The value of treatment for infertility: A systematic literature review of willingness-to-pay thresholds and approaches for determining the cost effectiveness of fertility therapies. Best Pract Res Clin Obstet Gynaecol. 2023;89:102340. Available from: https://doi.org/10.1016/j.bpobgyn.2023.102340.
- Keller E, Chambers GM. Valuing infertility treatment: Why QALYs are inadequate, and an alternative approach to cost-effectiveness thresholds. Front Med Technol. 2022;4:1053719. Available from: https://doi.org/10.3389/fmedt.2022.1053719.
- Rubio C, Navarro-Sánchez L, García-Pascual CM, Ocali O, Cimadomo D, Venier W, et al. Multicenter prospective study of concordance between embryonic cell-free DNA and trophectoderm biopsies from 1301 human blastocysts. Am J Obstet Gynecol. 2020;223(5):751.e1-.e13. Available from: https://doi.org/10.1016/j.ajog.2020.04.035.
14. Bilagor
14. Bilagor
- Appendix 1 Search strategies
- Appendix 2 Excluded studies after full text review and studies with criticial risk of bias
- Appendix 3 Granskningsmallar
- Appendix 4 Risk for bias assessments
- Appendix 5 Characteristics of included studies
- Appendix 6 Övriga resultat relaterade till effekten av PGT-A
- Appendix 7 Results for complications of PGT
- Appendix 8 Confounders that may affect different complications in the child and the pregnant woman
- Appendix 9 Characteristics of included health economic studies
- Appendix 10 Input values for effects in the health economic model, based on the systematic literature review of effects
 Statens beredning för medicinsk och social utvärdering
Statens beredning för medicinsk och social utvärdering
 Dela sidan på Facebook
Dela sidan på Facebook
 Dela sidan på LinkedIn
Dela sidan på LinkedIn
 Dela sidan via E-post
Dela sidan via E-post
