Observera att det är möjligt att ladda ner hela eller delar av en
publikation. Denna pdf/utskrift behöver därför inte vara komplett.
Hela publikationen och den senaste versionen hittar ni på
www.sbu.se/2019_10
Läkemedel för att förebygga och behandla posttraumatiskt stressyndrom (PTSD) hos vuxna
Publicerad: 26 november 2019
Här sammanfattar och kommenterar SBU en systematisk översikt från National Institute for Health and Care Excellence (NICE) som utvärderat effekterna av läkemedel för att förebygga eller behandla posttraumatiskt stressyndrom (PTSD) hos vuxna. PTSD kan uppkomma efter påfrestande, livshotande och traumatiska händelser som katastrofer, olyckor, våld, sexuella övergrepp och psykisk eller fysisk misshandel. Symtom på PTSD är att man återupplever den traumatiska händelsen, undviker situationer eller sinnesintryck som påminner om traumat, får negativa tankar och sinnesstämningar samt blir överspänd eller lättskrämd (se Faktaruta 1). PTSD kan leda till annan psykisk ohälsa och sjukdom [1].
National Institute for Health and Care Excellence (NICE). Post-traumatic stress disorder: [A] Evidence reviews for pharmacological interventions for the prevention and treatment of PTSD in adults. NICE guideline NG116 Evidence reviews.
Publicerad: December 2018
Senaste sökning: 2018-01-29
NICE-rapporten visar att det är möjligt att behandling med SSRI-läkemedel (sertralin, flouxetin och paroxetin) minskar symtom på posttraumatiskt stressyndrom (PTSD) och ökar antalet personer som tillfrisknar jämfört med placebo efter 8–13 veckors behandling. Det går däremot inte att bedöma om man kan förebygga PTSD med läkemedel. Många läkemedel och läkemedelsklasser har studerats som förebyggande behandling samt behandling vid diagnostiserad PTSD, exempelvis andra antidepressiva, antiepileptiska, antipsykotiska och anxiolytiska läkemedel. De flesta studier är dock små med låg kvalitet och det är oftast bara en studie per läkemedel, vilket gör att man inte kan dra några säkra slutsatser om vilka effekter andra läkemedel än SSRI har.
- Behandling med SSRI-läkemedel (sertralin, paroxetin och fluoxetin) gjorde att fler personer med posttraumatiskt stressyndrom (PTSD) gick i remission efter 8–12 veckors behandling, från 19,2 procent till 29,8 procent (cirka 1 av 10 tillfrisknar efter avslutad behandling). Klinikerskattningar och patientskattningar av PTSD-symtom visade ungefär likadana effektstorlekar. I Socialstyrelsens nationella riktlinjer för depression och ångest rekommenderas i första hand psykologiska behandlingsmetoder vid PTSD (prio 3) [2]. Läkemedelsbehandling med SSRI-läkemedel har prio 5.
- Doserna i studierna av SSRI-läkemedlen överensstämmer med de svenska rekommenderade doserna för att behandla depression och ångestsyndrom, inklusive PTSD. Paroxetin och sertralin har PTSD som godkänd behandlingsindikation.
- PTSD är ett komplext tillstånd med många olika symtom och svårighetsgrader vid till exempel komplexa, upprepade trauman (se Faktaruta 1). Det behövs mer forskning för att få en djupare kunskap om vilka effekter SSRI-läkemedel har, framför allt på längre sikt (över ett år). Det behövs även studier som jämför SSRI-läkemedel med psykologisk behandling samt som tillägg vid psykologisk behandling eller när psykologisk behandling inte har haft effekt för att tydliggöra läkemedlens plats i behandlingen av PTSD.
- Bensodiazepiner och andra anxiolytiska läkemedel har endast studerats i liten omfattning vid PTSD och man kan därför inte dra några säkra slutsatser om deras effekter.
Studierna i denna systematiska översikt av NICE har utvärderat läkemedelsbehandling för vuxna med risk för att utveckla kliniskt posttraumatiskt stressyndrom (PTSD) på grund av trauma samt för vuxna som redan utvecklat kliniskt dokumenterad PTSD. I de inkluderade studierna kan trauman vara både enskilda och upprepade händelser och exempelvis omfatta svåra olyckor, naturkatastrofer, att vara utsatt för eller bevittna våld och andra övergrepp. Studierna har genomförts inom alla världsdelar.
Sammanlagt inkluderades 33 randomiserade kontrollerade studier med 4 681 deltagare. Totalt exkluderades 88 studier vid fulltextläsning på grund av till exempel fel publikationstyp, utfallsmått eller studiedesign.
Följande läkemedel inkluderades i NICE-rapporten:
- SSRI-läkemedel (fluoxetin, paroxetin, sertralin)
- Tricykliska antidepressiva läkemedel (amitriptylin, imipramin)
- MAO-hämmare (brofaromin, phenelzin)
- SNRI-läkemedel (venlafaxin)
- Andra antidepressiva läkemedel (mirtazapin, nefazodon)
- Antiepileptiska läkemedel (karbamazepin, divalproex, lamotrigin, tiagabin, topiramat)
- Antipsykotiska läkemedel (olanzapin, risperidon)
- Anxiolytiska läkemedel (buspiron)
- Benzodiazepiner (alprazolam, klonazepam, diazepam, lorazepam)
- Andra läkemedel (klonidin, kortisol, d-cycloserin, ketamin, MDMA, neuropeptide-Y, oxytocin, prazosin, propranolol)
Följande utfallsmått inkluderades i NICE-översikten: PTSD-diagnos eller posttraumatiska symtom, acceptans och tolerabilitet, dissociativa symtom, funktionalitet inom olika livsområden, sömnsvårigheter, livskvalitet samt annan psykisk ohälsa.
Nedan sammanfattas de resultat som bedömdes ha låg tillförlitlighet eller högre enligt NICE:s evidensgradering (se Faktaruta 2 om GRADE). SBU redovisar endast utfallsmått som avser det primära utfallsmåttet PTSD och har inte inkluderat resultat som bygger på en enstaka studie eller studier med få deltagare1. Resultaten presenteras utförligt i Bilaga 1.
Behandling vid kliniskt säkerställd PTSD
- Den summerade effekten för olika SSRI-läkemedel (sertralin, fluoxetin och paroxetin) innebar minskad självskattad PTSD jämfört med placebo (16 studier, n=3 593) (SMD –0,26, 95 % KI, –0,39 till –0,14) efter 10–12 veckors behandling (låg tillförlitlighet
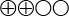 ).
).
- Den summerade effekten för olika SSRI-läkemedel (sertralin, fluoxetin och paroxetin) innebar att fler personer hamnade i klinikerskattad remission (det vill säga skattades mindre än 20 på CAPS-skalan eller uppfyllde inte diagnostiska kriterier för PTSD) jämfört med placebo (5 studier, n=1 527) 59/1 000 fler (95 % KI, från 13/1 000 till 113/1 000 fler) efter 8–12 veckors behandling (låg tillförlitlighet
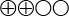 ).
).
- Den summerade effekten för olika SSRI-läkemedel (sertralin, fluoxetin och paroxetin) blev att fler personer förbättrades i sina PTSD-symtom (det vill säga mer än 30 % förbättring på CAPS-skalan eller IES-R, mer än 50 % förbättring på TOP8 eller mycket förbättrad eller väldigt mycket förbättrad på CGI-I-skalan) jämfört med placebo (11 studier, n=2 155), 143/1 000 fler (95 % KI, från 82/1 000 till 213/1 000 fler) efter 10–12 veckors behandling (låg tillförlitlighet
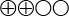 ).
).
- Det var ingen skillnad mellan personer som fått SSRI-läkemedel (sertralin, fluoxetin och paroxetin) ihop med traumafokuserad KBT och personer som fått enbart traumafokuserad KBT (2 studier, n=222) (SMD –0,1, 95 % KI, –0,39 till 0,18) avseende självskattade symtom på PTSD efter 12–26 veckors behandling (låg tillförlitlighet
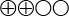 ).
).
- Det var ingen skillnad mellan personer som fått D-cycloserin ihop med exponeringsterapi och personer som fått placebo och exponeringsterapi avseende självskattade symtom på PTSD efter 3–10 veckor (2 studier, n=199, SMD 0,17, 95 % KI, –0,45 till 0,78, låg tillförlitlighet
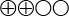 ) eller efter 13 veckor (2 studier, n=173, SMD 0,17, 95 % KI, –0,22 till 0,57, måttlig tillförlitlighet
) eller efter 13 veckor (2 studier, n=173, SMD 0,17, 95 % KI, –0,22 till 0,57, måttlig tillförlitlighet 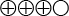 ) samt även för klinikerskattade symtom på PTSD efter 3–13 veckors behandling (2 studier, n=173, SMD 0,18, 95 % KI, –0,22 till 0,55, låg tillförlitlighet
) samt även för klinikerskattade symtom på PTSD efter 3–13 veckors behandling (2 studier, n=173, SMD 0,18, 95 % KI, –0,22 till 0,55, låg tillförlitlighet 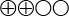 ) samt avseende andel personer i remission efter 6 till 10 veckor (3 studier, n=198) (46/1 000 fler i kontrollgruppen, 95 % KI, från 92 färre till 370 fler, låg tillförlitlighet
) samt avseende andel personer i remission efter 6 till 10 veckor (3 studier, n=198) (46/1 000 fler i kontrollgruppen, 95 % KI, från 92 färre till 370 fler, låg tillförlitlighet 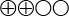 ).
).
NICE:s slutsatser och rekommendationer är resultatet av diskussioner och tolkningar som dess kommitté har gjort. NICE har utifrån ett engelskt hälso- och sjukvårdsperspektiv gjort prioriteringar av hur resurser ska användas (personal, lokaler, apparatur) och överväganden kring terapitraditioner, ekonomiskt utrymme, etiska och sociala faktorer med mera. De prioriteringar som NICE gör utgår därmed inte enbart från det vetenskapliga underlaget utan innefattar även andra hänsynstaganden. SBU har inte granskat eller tagit ställning till NICE:s prioriteringar eller rekommendationer, utan fokuserar på det vetenskapliga underlaget. NICE:s rekommendationer redovisas endast som information till läsaren. Observera att NICE också drar slutsatser från vetenskapligt underlag med mycket låg tillförlitlighet, vilket SBU inte gör.
Läkemedel för att förebygga PTSD efter en eller flera traumatiska händelser
- Enligt kommittén övervägde potentiella negativa effekter den eventuella nyttan av läkemedelsbehandling (escitalopram, hydrokortison, propranolol, bensodiazipiner och antiepileptika) för att förebygga att personer utvecklar PTSD efter ett trauma.
Läkemedel för att behandla kliniskt dokumenterad PTSD
- Kommittén menar att det är motiverat att rekommendera SSRI-läkemedel för personer som föredrar läkemedel framför psykologisk behandling. På grund av det begränsade vetenskapliga underlaget vill man dock förtydliga att SSRI-läkemedel inte ska vara förstahandsval för patienter som kan tänka sig psykologisk behandling utan ”övervägas”. Kommittén rekommenderar inte något speciellt SSRI-läkemedel, utan hänvisade till behandlande läkare. Kommittén gav inga rekommendationer om behandling med SSRI-läkemedel som tillägg till traumafokuserad KBT eller om SSRI-läkemedel som underhållsbehandling mot återfall i PTSD.
- Kommittén påpekade att det var nödvändigt att vara försiktig med rekommendationer av andra läkemedel på grund av det finns ett robustare vetenskapligt underlag för SSRI-läkemedel och psykologisk behandling. Kommittén menar dock att SNRI-läkemedlet venlafaxin kan övervägas vid PTSD. Trots svagt stöd (mycket låg tillförlitlighet) anger kommittén att det inte finns något som tyder på att venlafaxin har negativa effekter. Kommittén uttryckte även att antipsykotiska läkemedel kan övervägas vid PTSD, antingen som enskild behandling eller som tillägg till andra läkemedel. Kommittén anger dock att antipsykotiska läkemedel har ett svagare stöd än SSRI-läkemedel och psykologiska metoder och därför inte ska vara förstahandsval vid PTSD, utan övervägas som ett komplement till psykologisk behandling eller när patienten inte svarar på annan läkemedelsbehandling. Vidare menar kommittén att antipsykotiska läkemedel endast bör ges inom ramen för specialistvård eller efter specialistkonsultation.
Originalrapporten redogör inte för några framtida forskningsbehov.
Vid SBU:s genomgång av NICE-rapporten användes en granskningsmall för systematiska översikter som kallas AMSTAR. Granskningen visade att litteratursökning, studieurval och dataextraktion uppfyllde SBU:s kvalitetskrav för en systematisk översikt. SBU har inte granskat översiktens evidensgradering utan accepterat denna med undantag för när det gäller enstaka studier med få deltagare.
Tillståndet posttraumatiskt stressyndrom (PTSD) kan uppstå efter att en person har drabbats av eller bevittnat ett trauma. Traumat kan bestå av en avgränsad händelse, som till exempel en trafikolycka, en brand eller ett rån (enkla trauman), eller av upprepade händelser med skadlig emotionell och kognitiv påverkan under en lång period där det varit svårt eller omöjligt att undvika eller fly från situationen. Det kan till exempel vara tortyr, slaveri, folkmord, långvarigt och upprepat våld i nära relationer, sexuella eller fysiska övergrepp (komplexa trauman). Posttraumatiskt stressyndrom (PTSD) utmärks av
- påträngande minnen som är associerade med den traumatiska händelsen eller händelserna
- undvikande av tankar, minnen, händelser, situationer eller personer som kan påminna om händelsen
- försämrade kognitiva funktioner och negativa förändringar i sinnesstämning
- överspändhet som till exempel irritabilitet och argsinthet, lättskrämdhet, överdriven vaksamhet eller koncentrationssvårigheter.
I forskning används utöver de diagnostiska klassificeringssystemen DSM eller ICD även olika validerade skalor som mäter graden av posttraumatiska stressymtom, det vill säga om personen har fler eller färre symtom.
En systematisk litteraturöversikt väger samman resultat från olika studier. SBU använder det internationellt utarbetade GRADE-systemet för att göra en strukturerad bedömning av tillförlitligheten (evidensstyrkan) hos varje sammanvägt delresultat (utfall) i översikten. Den sakliga grunden för värderingen ska redovisas tydligt så att det är möjligt för andra att granska och göra sin egen bedömning.
Bedömningen av tillförlitlighet innefattar, för varje sammanvägt delresultat:
- hur stor risken är för systematiska fel i studierna (engelska: bias, snedvridning),
- hur mycket studierna motsäger varandra (engelska: inconsistency, bristande samstämmighet),
- i vilken grad som de studerade förhållandena skiljer sig från den aktuella frågan (engelska: indirectness, bristande överförbarhet),
- hur stor den statistiska osäkerheten är (engelska: imprecision, bristande precision) samt
- hur stor risken är för snedvriden publicering av studier och resultat (engelska: publication bias).
Hänsyn tas också till storleken på delresultatet, eventuellt samband mellan dos och respons samt i vilken riktning som tänkbara snedvridande faktorer kan förväntas verka.
För mer detaljerad beskrivning se metodboken [3]. Tillförlitligheten graderas i fyra nivåer:
(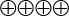 ) Det sammanvägda resultatet har hög tillförlitlighet (Bedömningen är att resultatet stämmer)
) Det sammanvägda resultatet har hög tillförlitlighet (Bedömningen är att resultatet stämmer)
(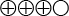 ) Det sammanvägda resultatet har måttlig tillförlitlighet (Bedömningen är att det är troligt att resultatet stämmer)
) Det sammanvägda resultatet har måttlig tillförlitlighet (Bedömningen är att det är troligt att resultatet stämmer)
(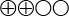 ) Det sammanvägda resultatet har låg tillförlitlighet (Bedömningen är att det är möjligt att resultatet stämmer)
) Det sammanvägda resultatet har låg tillförlitlighet (Bedömningen är att det är möjligt att resultatet stämmer)
(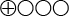 ) Det sammanvägda resultatet har mycket låg tillförlitlighet (Det går inte att bedöma om resultatet stämmer)
) Det sammanvägda resultatet har mycket låg tillförlitlighet (Det går inte att bedöma om resultatet stämmer)
När det helt saknas studier som uppfyller inklusionskriterierna anges ”studier saknas”, utan gradering av tillförlitligheten.
Steingrimsson S, Bilonic G, Ekelund A-C, Gondinger J, Larson T, Stadig I, Svensson M, Vukovic IS, Wartenberg C, Wrede N, Bernhardsson S. EEG-based neurofeedback as treatment for post-traumatic stress disorder [EEG-baserad neurofeedback som behandling för post-traumatiskt stressyndrom]. Göteborg: Västra Götalandsregionen, Sahlgrenska Universitetssjukhuset, HTA-centrum; 2019.Regional activity-based HTA 2019:105.
SBU. Psykologiska och psykosociala insatser för att förebygga posttraumatiskt stressyndrom (PTSD) hos barn och unga. Stockholm: Statens beredning för medicinsk och social utvärdering (SBU); 2019
SBU. Psykologisk, psykosocial och farmakologisk behandling för att behandla posttraumatiskt stressyndrom (PTSD) hos barn och unga. Stockholm: Statens beredning för medicinsk och social utvärdering (SBU); 2019
SBU. Psykologiska behandlingar vid posttraumatiskt stressyndrom (PTSD) hos flyktingar och asylsökande. Stockholm: Statens beredning för medicinsk och social utvärdering (SBU); 2019
- Alisic E, Zalta AK, van Wesel F, Larsen SE, Hafstad GS, Hassanpour K, et al. Rates of post-traumatic stress disorder in trauma exposed children and adolescents: meta-analysis. Br J Psychiatry 2014;204:335-40.
- Socialstyrelsen. Vård vid depression och ångestsyndrom – Stöd för styrning och ledning. Nationella riktlinjer 2017. Stockholm: Socialstyrelsen; 2017. ISBN 978-91-7555-436-5.
- SBU. Utvärdering av metoder i hälso- och sjukvården: En handbok. Tredje upplagan. Stockholm: Statens beredning för medicinsk utvärdering (SBU). Hämtad från www.sbu.se/metodbok den 20 november 2019.
Sigurd Vitols, medicinsk sakkunnig
Lina Leander, projektledare
Caroline Jungner, projektadministratör
Mussie Msghina, MD, PhD, docent, Senior Lecturer, Örebro University, School of Medical Sciences
Sakkunniga och granskare har i enlighet med SBU:s krav inlämnat deklaration rörande bindningar och jäv. Dessa dokument finns tillgängliga på SBU:s kansli. SBU har bedömt att de förhållanden som redovisas där är förenliga med kraven på saklighet och opartiskhet.
Tabell 1 Sammanställning av resultaten. Här presenteras endast jämförelser som bygger på mer än en studie.
| CAPS = Clinician Administered PTSD Scale; CGI-I = Clinical Global Impression scale-Global Improvement; DTS = Davidson Trauma Scale; HTQ = Harvard Trauma Questionnaire; IES = Impact of Event Scale; IES-R = Impact of Event Scale-Revised; KBT = Kognitiv beteendeterapi; PCL = PTSD Checklist for DSM-5; PDS = Post-traumatic Diagnostic Scale; PSS-SR = PTSD Symptom Scale-Self Report; PTSD = Posttraumatiskt stressyndrom; RR = Riskkvot; SI PTSD = Structured Interview for PTSD; SMD = Standardiserad medelvärdesskillnad; SSRI = Selektiva serotoninåterupptagshämmare, SSR-läkemedel; TCA = Tricykliska antidepressiva; TOP-8 = Treatment Outcome PTSD Scale |
| Jämförelse |
Antal studier/
Patienter |
Utfallsmått
uppföljning |
Resultat |
Tillförlitlighet |
Figur (i originalrapporten) |
Propranolol jämfört med placebo
Tidig prevention (inom 1 månad) |
2/
72 |
Klinikerskattade symtom på PTSD CAPS endpoint score)
Efter 1 månad |
SMD –0,16
(–0,63 till 0,31)
Ingen skillnad |
Låg
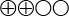
SBU bedömer att detta resultat har mycket låg tillförlighet då det bygger på få deltagare |
Figur 22 |
Propranolol jämfört med placebo
Tidig prevention (inom 1 månad) |
2/
81 |
PTSD-diagnos (CAPS)
Efter 1 månad |
RR 1,06
(0,61 till 1,83)
22 fler av 1 000 (från 143 färre till 304 fler)
Ingen skillnad |
Mycket låg
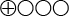 |
Figur 25 |
Propranolol jämfört med placebo
Tidig prevention (inom 1 månad) |
3/
118 |
PTSD-diagnos (CAPS)
Efter 2–3 månader |
RR 1,18
(0,74 till 1,89) 62 fler av 1 000 (från 90 färre till 306 fler)
Ingen skillnad |
Mycket låg
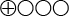 |
Figur 26 |
SSRI jämfört med placebo
Diagnostiserad PTSD efter minst 3 månader |
16/
3 593 |
Självskattade symtom på PTSD (DTS/IES-R change score)
Efter 10–12 veckor |
SMD –0,26
(–0,39 till –0,14)
Fördel SSRI |
Låg
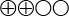 |
Figur 38 |
SSRI jämfört med placebo
Diagnostiserad PTSD efter minst 3 månader |
17/
3 475 |
Klinikerskattade symtom på PTSD (CAPS/SI-PTSD change score)
Efter 8–12 veckor |
SMD –0,28
(–0,39 till –0,16)
Fördel SSRI |
Mycket låg
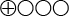 |
Figur 39 |
SSRI jämfört med placebo
Diagnostiserad PTSD efter minst 3 månader |
5/
1 527 |
PTSD-remission (mindre än 20 på CAPS-skalan eller som inte uppfyller diagnostiska kriterier för PTSD)
Efter 8–12 veckor |
RR 1,31
(1,07 till 1,59)
59 fler av 1 000 (från 13 fler till 113 fler)
Fördel SSRI |
Låg
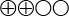 |
Figur 40 |
SSRI jämfört med placebo
Diagnostiserad PTSD efter minst 3 månader |
11/
2 155 |
Andel som svarar på behandling (antal personer med över ≥ 30 % förbättring i CAPS eller IES-R/≥ 50 % förbättring i TOP-8 och/eller CGI-I förbättrad eller mycket förbättrad
Efter 10–12 veckor |
RR 1,35
(1,2 till 1,52)
143 fler av 1 000 (från 82 fler till 213 fler)
Fördel SSRI |
Låg
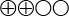 |
Figur 42 |
SSRI jämfört med placebo
Underhållsbehandling av PTSD-symtom |
3/
2 155 |
Återfall (antal personer som återföll i PTSD)
Efter 24–28 veckor |
RR 0,51
(0,25 till 1,06)
189 färre av 1 000 (från 289 färre till 23 fler)
Fördel SSRI |
Mycket låg
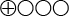 |
Figur 121 |
SSRI jämfört med placebo
Underhållsbehandling av PTSD-symptom |
2/
211 |
Självskattade symtom på PTSD (DTS change score)
Efter 24–28 veckor |
SMD 0,24
(0,87 till 0,39)
Ingen skillnad |
Mycket låg
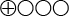 |
Figur 122 |
SSRI + traumafokuserad KBT jämfört med traumafokuserad KBT
Diagnostiserad PTSD efter minst 3 månader |
2/
222 |
Självskattade symtom på PTSD(HTQ/PDS change score)
Efter 12–26 veckor |
SMD 0,1
(0,39 till 0,18)
Ingen skillnad |
Låg
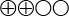 |
Figur 128 |
SSRI + traumafokuserad KBT jämfört med traumafokuserad KBT
Diagnostiserad PTSD efter minst 3 månader |
2/
141 |
Självkattade symtom på PTSD (PDS change score)
Efter 10–12 veckor |
SMD 0,6
(1,39 till 0,19)
Ingen skillnad |
Mycket låg
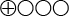 |
Figur 130 |
SSRI + traumafokuserad KBT jämfört med traumafokuserad KBT
Diagnostiserad PTSD efter minst 3 månader |
2/
208 |
Remission (antal individer som inte längre möter kriterier för PTSD-diagnos (scoring ≤20 on CAPS & CGI-I score=1)
Efter 10–12 veckor |
RR 1,07
(0,24 till 4,69)
40 fler av 1 000 (från 432 färre till 1 000 fler)
Ingen skillnad |
Mycket låg
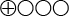 |
Figur 131 |
TCA jämfört med placebo
Diagnostiserad PTSD efter minst 3 månader |
2/
74 |
Självskattade symtom på PTSD (IES change score)
Efter 8 veckor |
SMD 0,64
(–1,11 till 0,16)
Fördel TCA |
Mycket låg
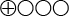 |
Figur 141 |
TCA jämfört med placebo
Diagnostiserad PTSD efter minst 3 månader |
2/
87 |
Andel som svarar på behandling (antal personer med över ≥50 % förbättring i SI–PTSD/ förbättrad eller mycket förbättrad i CGI-I)
Efter 8 veckor |
RR 2,13
(1,08 till 4,19)
232 fler av 1 000 (från 16 fler till 654 fler)
Fördel TCA |
Mycket låg
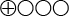 |
Figur 143 |
Topiramat jämfört med placebo
Diagnostiserad PTSD efter minst 3 månader |
3/
136 |
Klinikerskattade symtom på PTSD (CAPS change score)
Efter 12 veckor |
SMD 1,25
(–2,61 till 0,11)
Fördel Topiramat |
Mycket låg
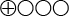 |
Figur 183 |
Antipsykotiska läkemedel jämfört med placebo
Diagnostiserad PTSD efter minst 3 månader |
2/
108 |
Självskattade symptom på PTSD (DTS change score)
Efter 8–12 veckor |
SMD 0,84
(1,23, 0,44)
Fördel antipsykotiska läkemedel |
Mycket låg
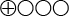 |
Figur 206 |
Antipsykotiska läkemedel jämfört med placebo
Diagnostiserad PTSD efter minst 3 månader |
3/
355 |
Klinikerskattade symtom på PTSD (CAPS change score)
Efter 8–12 veckor |
SMD 0,75
(1,38, 0,11)
Fördel antipsykotiska läkemedel |
Mycket låg
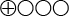 |
Figur 207 |
Antipsykotiska läkemedel som tillägg till rutinbehandling jämfört med placebo
Diagnostiserad PTSD efter minst 3 månader |
2/
72 |
Klinikerskattade symtom på PTSD (CAPS change score)
Efter 9–16 veckor |
SMD 0,51
(0,98 till 0,04)
Fördel antipsykotiska läkemedel |
Mycket låg
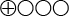 |
Figur 229 |
Prazosin jämfört med placebo
Diagnostiserad PTSD efter minst 3 månader |
4/
480 |
Klinikerskattade symtom på PTSD (CAPS/MINI change score)
Efter 8–26 veckor |
SMD 0,81
(1,71 till 0,1)
Ingen skillnad |
Mycket låg
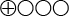 |
Figur 251 |
D-cycloserin (+ exponeringsterapi) jämfört med placebo (+ exponeringsterapi)
Diagnostiserad PTSD efter minst 3 månader |
2/
199 |
Självskattade symtom på PTSD (PCL/PSS-SR change score)
Efter 3–10 veckor |
SMD 0,17
(–0,45 till 0,78)
Ingen skillnad |
Låg
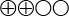 |
Figur 277 |
D-cycloserin (+ exponeringsterapi) jämfört med placebo (+ exponeringsterapi)
Diagnostiserad PTSD efter minst 3 månader |
2/
173 |
Självskattade symtom på PTSD (PSS-SR change score)
Efter 13 veckor |
SMD 0,17
(–0,22 till 0,57)
Ingen skillnad |
Måttlig
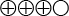 |
Figur 278 |
| D-cycloserin (+ exponeringsterapi) jämfört med placebo (+ exponeringsterapi) |
4/
224 |
Klinikerskattade symtom på PTSD (CAPS change score)
Efter 3-10 veckor |
SMD 0,03
(–0,64 till 0,58)
Ingen skillnad |
Mycket låg
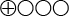 |
Figur 281 |
| D-cycloserin (+exponeringsterapi) jämfört med placebo (+exponeringsterapi) |
2/
173 |
Klinikerskattade symtom på PTSD (CAPS change score)
Efter 13 veckor |
SMD 0,18
(–0,2 till 0,55)
Ingen skillnad |
Låg
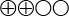 |
Figur 282 |
| D-cycloserin (+ exponeringsterapi) jämfört med placebo (+ exponeringsterapi) |
2/
131 |
Klinikerskattade symtom på PTSD (CAPS change score)
Efter 26 veckor |
SMD 0,03
(–0,64 till 0,58)
Ingen skillnad |
Mycket låg
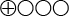 |
Figur 283 |
| D-cycloserin (+ exponeringsterapi) jämfört med placebo (+ exponeringsterapi) |
3/
198 |
Remission (antal individer <20 på CAPS/som inte längre uppfyller kriterierna för diagnos)
Efter 6–10 veckor
Ingen skillnad |
RR 1,24
(0,52 till 2,93)
46 fler av 1 000 (från 92 färre till 370 fler) |
Låg
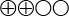 |
Figur 285 |
| D-cycloserin (+ exponeringsterapi) jämfört med placebo (+ exponeringsterapi) |
2/
173 |
Remission (antal individer <20 på CAPS/som inte längre uppfyller kriterierna för diagnos)
Efter 13 veckor
Ingen skillnad |
RR 1,15
(0,31 till 4,25)
33 fler av 1 000 (från 151 färre till 710 fler) |
Mycket låg
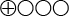 |
Figur 286 |
| D-cycloserin (+ exponeringsterapi) jämfört med placebo (+ exponeringsterapi) |
2/
131 |
Remission (antal individer <20 på CAPS/som inte längre uppfyller kriterierna för diagnos)
Efter 26 veckor
Ingen skillnad |
RR 1,4
(0,19 till 10,39)
92 fler av 1 000 (från 187 färre till 1 000 fler) |
Mycket låg
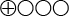 |
Figur 287 |
Tabell 2 Subgruppsanalyser för specifika SSRI-preparat.
| CAPS = Clinician Administered PTSD Scale; DTS = Davidson Trauma Scale; IES-R = Impact of Event Scale-Revised; PTSD = Posttraumatiskt stressyndrom; RR = Riskkvot; SI PTSD = Structured Interview for PTSD; SMD = Standardiserad medelvärdesskillnad; SSRI = Selektiva serotoninåterupptagshämmare, SSR-läkemedel |
| Jämförelse |
Antal studier/
patienter |
Utfallsmått uppföljning |
Resultat |
Tillförlitlighet |
Figur (i originalrapporten) |
Sertralin jämfört med placebo
Diagnostiserad PTSD efter minst 3 månader |
8/
1 399 |
Klinikerskattade symtom på PTSD (DTS/IES-R change score)
Direkt efter insats |
SMD –0,25
(–0,45 till –0,04)
Fördel Sertralin |
Ingen evidensgradering |
Figur 53 |
Fluoxetin jämfört med placebo
Diagnostiserad PTSD efter minst 3 månader |
4/
762 |
Självskattade symtom på PTSD (DTS/IES-R change score)
Direkt efter insats |
SMD –0,40
(–0,79 till –0,01)
Fördel Fluoxetin |
Ingen evidensgradering |
Figur 53 |
Paroxetin jämfört med placebo
Diagnostiserad PTSD efter minst 3 månader |
4/
1 374 |
Självskattade symtom på PTSD (DTS/IES-R change score)
Direkt efter insats |
SMD –0,31
(–0,45 till –0,17)
Fördel Paroxetin |
Ingen evidensgradering |
Figur 53 |
Sertralin jämfört med placebo
Diagnostiserad PTSD efter minst 3 månader |
7/
1 299 |
Klinikerskattade symptom på PTSD (CAPS/SI–PTSD change score) |
SMD –0,22
(–0,42 till –0,01)
Fördel Sertralin |
Ingen evidensgradering |
Figur 54 |
Fluoxetin jämfört med placebo
Diagnostiserad PTSD efter minst 3 månader |
4/
705 |
Klinikerskattade symptom på PTSD (CAPS/SI–PTSD change score) |
SMD –0,41
(–0,76 till –0,07)
Fördel Fluoxetin |
Ingen evidensgradering |
Figur 54 |
Paroxetin jämfört med placebo
Diagnostiserad PTSD efter minst 3 månader |
4/
1 413 |
Klinikerskattade symptom på PTSD (CAPS/SI–PTSD change score) |
SMD –0,35
(–0,49 till –0,20)
Fördel Paroxetin |
Ingen evidensgradering |
Figur 54 |
Sertralin jämfört med placebo
Diagnostiserad PTSD efter minst 3 månader |
2/
737 |
Remission (antal individer <20 på CAPS/som inte längre uppfyller kriterierna för diagnos) |
RR 1,41
(1,05 till 1,90)
143 fler av 1 000 (från 82 fler till 213 fler)
Fördel Sertralin |
Ingen evidensgradering |
Figur 55 |
Fluoxetin jämfört med placebo
Diagnostiserad PTSD efter minst 3 månader |
2/
467 |
Remission (antal individer <20 på CAPS/som inte längre uppfyller kriterierna för diagnos) |
RR 1,06
(0,79 till 1,42)
143 fler av 1 000 (från 82 fler till 213 fler)
Ingen skillnad |
Ingen evidensgradering |
Figur 54 |
Sertralin jämfört med placebo
Diagnostiserad PTSD efter minst 3 månader |
5/
540 |
Andel personer som svarar på behandling (≥30 % förbättring i CAPS eller IES-R/≥50 %) |
RR 1,25
(1,01 till 1,55)
143 fler av 1 000 (från 82 fler till 213 fler)
Fördel Sertralin |
Ingen evidensgradering |
Figur 57 |
Fluoxetin jämfört med placebo
Diagnostiserad PTSD efter minst 3 månader |
2/
355 |
Andel personer som svarar på behandling
(≥30 % förbättring i CAPS eller IES-R/≥50 %) |
RR 1,39
(1,12 till 1,72)
143 fler av 1 000 (från 82 fler till 213 fler)
Ingen skillnad |
Ingen evidensgradering |
Figur 57 |
Paroxetin jämfört med placebo
Diagnostiserad PTSD efter minst 3 månader |
4/
1 260 |
Andel personer som svarar på behandling
(≥30 % förbättring i CAPS eller IES-R/≥50 %) |
RR 1,44
(1,16 till 1,79)
143 fler av 1 000 (från 82 fler till 213 fler)
Fördel Paroxetin |
Ingen evidensgradering |
Figur 57 |


![]() ).
).![]() ) Det sammanvägda resultatet har hög tillförlitlighet (Bedömningen är att resultatet stämmer)
) Det sammanvägda resultatet har hög tillförlitlighet (Bedömningen är att resultatet stämmer)![]() ) Det sammanvägda resultatet har måttlig tillförlitlighet (Bedömningen är att det är troligt att resultatet stämmer)
) Det sammanvägda resultatet har måttlig tillförlitlighet (Bedömningen är att det är troligt att resultatet stämmer)![]() ) Det sammanvägda resultatet har låg tillförlitlighet (Bedömningen är att det är möjligt att resultatet stämmer)
) Det sammanvägda resultatet har låg tillförlitlighet (Bedömningen är att det är möjligt att resultatet stämmer)![]() ) Det sammanvägda resultatet har mycket låg tillförlitlighet (Det går inte att bedöma om resultatet stämmer)
) Det sammanvägda resultatet har mycket låg tillförlitlighet (Det går inte att bedöma om resultatet stämmer)